题目内容
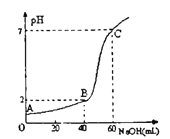
【题目】某化学反应2AB+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表所示,表中温度为摄氏度(℃).
实验 | 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,回答下列问题:
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为
(2)在实验1中,c1数值为
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验(选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3800(选填“<”或“>”).
【答案】
(1)0.02mol/(L?min)
(2)0.50
(3)2
(4)>
【解析】解:(1)反应在10~20分钟内用A表示的平均速率为v= ![]() =
= ![]() =0.02mol/(Lmin), 所以答案是:0.02mol/(Lmin); (2)实验2中,30min中便达到了化学平衡,平衡后,各组分浓度不随时间的改变而改变,所以c1=0.50 mol/L,所以答案是:0.50;(3)实验2中,反应经20min,A的浓度不再改变,说明达到平衡,较其它实验达到平衡时间最短,故使用了合适的催化剂,所以答案是:2;(4)温度越高化学反应速率越快,单位时间内A的平均速率为v1=0.02mol/(Lmin),v3=
=0.02mol/(Lmin), 所以答案是:0.02mol/(Lmin); (2)实验2中,30min中便达到了化学平衡,平衡后,各组分浓度不随时间的改变而改变,所以c1=0.50 mol/L,所以答案是:0.50;(3)实验2中,反应经20min,A的浓度不再改变,说明达到平衡,较其它实验达到平衡时间最短,故使用了合适的催化剂,所以答案是:2;(4)温度越高化学反应速率越快,单位时间内A的平均速率为v1=0.02mol/(Lmin),v3= ![]() =0.03mol/(Lmin),故实验三的速率快,即温度高,故T3>800,
=0.03mol/(Lmin),故实验三的速率快,即温度高,故T3>800,
所以答案是:>.

【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则表示H2的燃烧热的热化学方程式为_________
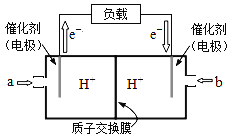
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图放电时甲醇应从____处通入(填“a”或“b”).电池内部H+向______(填“左”或“右”)移动。写出电池负极的电极反应式_____。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知:N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol,试根据表中所列键能数据计算a的数值__________。
化学键 | H-H | N-H | N≡N |
键能/kJmol | 436 | a | 945 |
当可逆反应中净生成N-H物质的量为2mol时,反应放热________
(4) 已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJmol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.