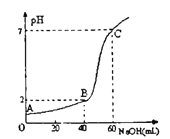
题目内容
【题目】工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是

A. 电极a为电池的负极
B. 电极b上的电极反应式为:O2+4H++4e-=2H2O
C. 若电路中通过2 mol电子,则电池内部释放632 kJ热能
D. 若有17 g H2S参与反应,则会有1 mol H+经质子膜进入正极区
【答案】C
【解析】试题分析:该电池属于燃料电池,通入燃料的为负极,通入空气或氧气的为正极,电极a为电池的负极,故A正确;根据图示,电极b上发生的电极反应为:O2+4H++4e-=" 2" H2O,故B正确;根据方程式,电路中每流过4mol电子,有2molH2S发生反应,电池内部释放632kJ的总能量,部分以电能的形式发出,部分以其他形式的能量发出,故C错误; 17gH2S的物质的物质的量为0.5mol,则会有1molH+经质子膜进入正极区,故D正确。

练习册系列答案
相关题目