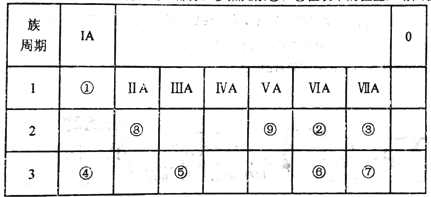
��Ŀ����
����Ŀ�������йؼ���ķ�����ȷ����
A. ij��Һ100 mL�����к�����0.03 mol������0.04 mol�����ڸ���Һ��Ͷ��1.92 gͭ���ȣ���Ӧ��ų�һ����������ԼΪ0.015 mol
B. ����ʱ�����ݻ�Ϊa mL���Թ��г���NO2���壬Ȼ������ˮ�е�����ˮ�治������ʱΪֹ����ͨ��b mL O2�������Һ���ּ�������������Թ������ʣ������Ϊc mL���Ҹ����岻��֧��ȼ�գ���a��b�Ĺ�ϵ��a��4b��c
C. ��ӦKClO4��8HCl===KCl��4Cl2����4H2O�У�ÿ����4 mol Cl2ת�Ƶĵ�����Ϊ8NA
D. ���������������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��Fe3O4��HNO3(ϡ) ![]() Fe(NO3)3��NO����H2O(δ��ƽ)23.2 g������������ȫ�ܽ���ϡ�����У�ת��0.1 mol����
Fe(NO3)3��NO����H2O(δ��ƽ)23.2 g������������ȫ�ܽ���ϡ�����У�ת��0.1 mol����
���𰸡�D
��������ͭ��ϡ���ᷴӦ��ʵ����3Cu+8H++2NO3-=3Cu2++2NO��+4H2O,����Һ��ÿ3molCu��8molH+��ȫ��Ӧ����2molNO����,���л����Һ�к�H+�����������к�0.06mol,�����к�0.04mol,������Һ�й���0.1molH+,1.92gͭ�����ʵ���Ϊ0.03mol,�������ӷ���ʽ���Ĺ�ϵ,![]() ,�����ӹ���,ͭ������ȫ��Ӧ,���ɵ�NO������ͭ�����ʵ�������ó�,�������ʵ���Ϊ0.02mol,A�����ݷ�Ӧ3NO2+H2O=2HNO3+NO, amLNO2������a/3mLNO ,ͨ��O2��,������岻֧��ȼ��,��cLΪNO,����b mLO2��Ӧ��NOΪ(a/3-c)mL,���ݷ���ʽ:4NO+3O2+2H2O=4HNO3,��(a/3-c):b=4:3,�����ɵ�a=4b+3c��B����ӦKClO4��8HCl===KCl��4Cl2����4H2O�У�KClO4��+7���Ƚ��͵�0���ȣ�1mol KClO4��ȫ��Ӧ��ת��7mol���ӣ���7NA��C�����������������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��3Fe3O4��28HNO3(ϡ)===9Fe(NO3)3��NO����14H2O��3molFe3O4��ȫ��Ӧת��3mol���ӣ���23.2gFe3O4(0.1 mol)��ȫ��Ӧת��0.1 mol���ӣ�D��ȷ����ȷѡ��D��
,�����ӹ���,ͭ������ȫ��Ӧ,���ɵ�NO������ͭ�����ʵ�������ó�,�������ʵ���Ϊ0.02mol,A�����ݷ�Ӧ3NO2+H2O=2HNO3+NO, amLNO2������a/3mLNO ,ͨ��O2��,������岻֧��ȼ��,��cLΪNO,����b mLO2��Ӧ��NOΪ(a/3-c)mL,���ݷ���ʽ:4NO+3O2+2H2O=4HNO3,��(a/3-c):b=4:3,�����ɵ�a=4b+3c��B����ӦKClO4��8HCl===KCl��4Cl2����4H2O�У�KClO4��+7���Ƚ��͵�0���ȣ�1mol KClO4��ȫ��Ӧ��ת��7mol���ӣ���7NA��C�����������������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��3Fe3O4��28HNO3(ϡ)===9Fe(NO3)3��NO����14H2O��3molFe3O4��ȫ��Ӧת��3mol���ӣ���23.2gFe3O4(0.1 mol)��ȫ��Ӧת��0.1 mol���ӣ�D��ȷ����ȷѡ��D��

����Ŀ����ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1�����������Ƚ���(��Ҫ�ɷ�ΪCO��CH4��H2)��SO2��һ�������»�ԭΪ�������������������֪��
��C(s)+O2(g)=CO2(g) ��H1=-393.5 kJ��mol-1
��CO2(g)+C(s)=2CO(g) ��H2= + 172.5 kJ��mol-1
��S(s)+O2(g)=SO2(g) ��H3=- 296.0 kJ��mol-1
CO��SO2 ��ԭΪ��������Ȼ�ѧ����ʽΪ_____________________________________��
��2��CO�����ںϳɼ״���һ���¶��£������Ϊ2 L���ܱ������м���CO��H2��������ӦCO(g)+2H2(g)![]() CH3OH(g)���ﵽƽ����ø���ֵ�Ũ��������
CH3OH(g)���ﵽƽ����ø���ֵ�Ũ��������
���� | CO | H2 | CH3OH |
Ũ�ȣ�mol��L-1�� | 0.9 | 1.0 | 0.6 |
����Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ_______________��
���÷�Ӧ��ƽ�ⳣ��K=________________��
�����º��������£�����˵����Ӧ�Ѵﵽƽ��״̬����__________(����)��
A��v��(CO)=2v��(H2) B�����������ܶȲ���
C����������ƽ����Է����������� D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
�������������ѹ����1L����ﵽ��ƽ��ʱc(H2)��ȡֵ��Χ��_____________��
������������������䣬�ٳ���0.6molCO��0.4molCH3OH����ʱv��__________v��(����>��<������=��)��
��3����������HNO2�ĵ��볣��Ka=7.1��10-4mol��L-1��NH3��H2O�ĵ��볣��Kb=1.7��10-5mol��L-1��0.1mol��L-1NH4NO2��Һ������Ũ���ɴ�С��˳����__________��������NO2-ˮ�ⷴӦ��ƽ�ⳣ��Kb=__________(������λ��Ч����)��