题目内容
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2 还原为单质硫的热化学方程式为_____________________________________。
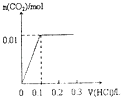
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①反应达到平衡时,CO的转化率为_______________。
②该反应的平衡常数K=________________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__________v逆(填“>”<”或“=”)。
(3)常温下,HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kb=__________(保留两位有效数字)。
【答案】 2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ·mol-1 40% ![]() L2·mol-2(或0.67L2·mol-2) CD 1mol·L-1<c(H2)<2mol·L-1 = c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
L2·mol-2(或0.67L2·mol-2) CD 1mol·L-1<c(H2)<2mol·L-1 = c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
【解析】(1)已知反应①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
根据盖斯定律,由①-②-③得反应2CO(g)+SO2(g)=S(s)+2CO2(g) △H= △H1-△H2-△H3=-393.5 kJ·mol-1-172.5 kJ·mol-1-(- 296.0 kJ·mol-1)=-270kJ·mol-1;
(2) CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L)1.5 2.2 0
改变浓度(mol/L)0.6 1.2 0.6
平衡浓度(mol/L)0.9 1.0 0.6
①反应达到平衡时,CO的转化率为![]() ×100%=40%;②该反应的平衡常数K=
×100%=40%;②该反应的平衡常数K=![]() =
=![]() =
=![]() L2·mol-2=0.67L2·mol-2);③A.根据化学反应速率之比等于计量数之比,有2v正(CO)= v正(H2),若2v正(CO)= v正(H2)= v逆(H2)则正逆反应速率相等,反应达到平衡状态,但题给的是v正(CO)=2v逆(H2),选项A错误;B.反应在恒容条件下进行,反应物都为气体,故气体的总质量不变,容器的体积不变,密度始终保持不变,所以混合气体的密度不变不能作为反应达到平衡的标志,选项B错误; C.根据“变量不变达平衡”该反应正反应为气体体积缩小的反应,混合气体的平均相对分子质量是变量,若不变了,证明反应已达平衡状态,选项C正确;D.CH3OH、CO、H2的浓度都不再发生变化,反应物各浓度保持不变,说明反应已达平衡状态,选项D正确。答案选CD;④CO(g)+2H2(g)
L2·mol-2=0.67L2·mol-2);③A.根据化学反应速率之比等于计量数之比,有2v正(CO)= v正(H2),若2v正(CO)= v正(H2)= v逆(H2)则正逆反应速率相等,反应达到平衡状态,但题给的是v正(CO)=2v逆(H2),选项A错误;B.反应在恒容条件下进行,反应物都为气体,故气体的总质量不变,容器的体积不变,密度始终保持不变,所以混合气体的密度不变不能作为反应达到平衡的标志,选项B错误; C.根据“变量不变达平衡”该反应正反应为气体体积缩小的反应,混合气体的平均相对分子质量是变量,若不变了,证明反应已达平衡状态,选项C正确;D.CH3OH、CO、H2的浓度都不再发生变化,反应物各浓度保持不变,说明反应已达平衡状态,选项D正确。答案选CD;④CO(g)+2H2(g)![]() CH3OH(g),若将容器体积压缩为1L,各物质浓度应变为原来的2倍,但压强增大,平衡向气体体积减小的正反应方向移动,故氢气的平衡浓度小于2mol/L,所以氢气的平衡浓度应1mol/L<c(H2)<2mol/L;⑤若保持体积不变,再充入0.6molCO和0.4molCH3OH,则 各物质浓度为
CH3OH(g),若将容器体积压缩为1L,各物质浓度应变为原来的2倍,但压强增大,平衡向气体体积减小的正反应方向移动,故氢气的平衡浓度小于2mol/L,所以氢气的平衡浓度应1mol/L<c(H2)<2mol/L;⑤若保持体积不变,再充入0.6molCO和0.4molCH3OH,则 各物质浓度为
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
0.9+0.6=1.5 1.0 0.6+0.4=1
Q=![]() =
=![]() =K,说明反应达到的平衡和原来的平衡状态相同,则V正=V逆;(3)常温下,HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。Ka>Kb,NH4NO2溶液中铵根离子的水解大于亚硝酸根离子的水解,c(NO2-)>c(NH4+),溶液呈酸性,故0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是c(NO2-)>c(NH4+)>c(H+)>c(OH-),NO2-水解的离子方程式为NO2-+H2O=HNO2+ OH-,常温下NO2-水解反应的平衡常数Kb=
=K,说明反应达到的平衡和原来的平衡状态相同,则V正=V逆;(3)常温下,HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。Ka>Kb,NH4NO2溶液中铵根离子的水解大于亚硝酸根离子的水解,c(NO2-)>c(NH4+),溶液呈酸性,故0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是c(NO2-)>c(NH4+)>c(H+)>c(OH-),NO2-水解的离子方程式为NO2-+H2O=HNO2+ OH-,常温下NO2-水解反应的平衡常数Kb= =
=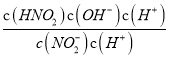 =
=![]() =
=![]() =1.4×10-11。
=1.4×10-11。

【题目】铋是一种绿色稀有金属,铋及其化合物在工业生产中用途广泛,工业上常采用粗铋精炼制得用途更为广泛的精炼铋(含铋99.995%),火法精炼铋的工艺流程如下:

已知:①粗铋(铅铋合金)的主要化学成分如下表:
元素 | Ag | Bi | Pb | As | Sb |
含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在________(填主要仪器名称)中完成。
(2)NaBiO3中铋元素的化合价为________。
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的_______性将杂质砷、锑转变成As2O3、Sb2O3而除去。
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈_______态覆盖,防止氯气__________________。
(5)高温精炼的实质为碱性精炼,加入少量KNO3和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式: __________________。
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式__________________。