题目内容
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
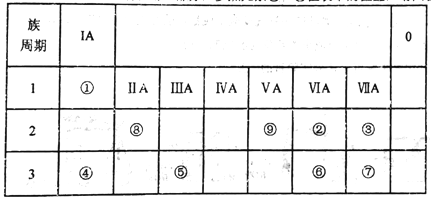
(1)③、④、⑦的原子半径由大到小的顺序是___________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比lmo1⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________。
(5)已知W+X=Y+Z (反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
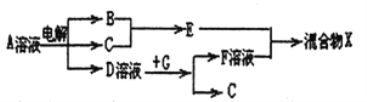
①写出D溶液与G反应的离子方程式_______________。
②写出检验A溶液中溶质的阴离子的方法_______________。
【答案】 Na>Cl>F AC H2O2+2Fe2++2H+=2Fe3++2H2O Be(OH)2+2NaOH=Na2BeO2+2H2O NH4++OH-![]() NH3↑+H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成
NH3↑+H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成
【解析】试题分析:根据元素周期表,①是H元素;②是O元素;③是F元素;④是Na元素;⑤是Al元素;⑥是S元素;⑦是Cl元素;⑧是Be元素;⑨是N元素。
解析:(1)同周期元素从左到右半径减小,所以Na>Cl;同主族元素从上到下半径增大,所以Cl>F,故半径Na>Cl>F;(2)A.氧气与H2S溶液反应生成单质硫,溶液变浑浊,说明氧气的氧化性大于S,能证明O元素的非金属性比S元素的非金属性强,故A正确;氧化性强弱与得失电子难易有关,与得失电子多少无关,故B错误;H2O的分解温度大于H2S,说明H2O的热稳定性大于H2S,能证明O元素的非金属性比S元素的非金属性强,故C正确;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物是H2O2,在酸性溶液中H2O2能将Fe2+氧化为Fe3+,该反应的离子方程式是H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)根据氢氧化铝与氢氧化钠反应的方程式,Be(OH)2与NaOH反应生成Na2BeO2,反应化学方程式是Be(OH)2+2NaOH=Na2BeO2+2H2O;
(5)已知W+X=Y+Z(反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),则W、X、Y、Z分别是NH4+、OH-、NH3、H2O,该化学方程式是NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
(6)B为黄绿色气体,B是氯气,已知电解饱和食盐水可生成氢气、氯气、氢氧化钠,D溶液显碱性,所以D是氢氧化钠,A是氯化钠;单质G能与氢氧化钠溶液反应生成氢气,所以G是铝;F是偏铝酸钠;①氢氧化钠溶液与铝反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;②A是氯化钠溶液,检验氯离子的方法是取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液,若有白色沉淀生成,则含有氯离子。

 阅读快车系列答案
阅读快车系列答案