题目内容
1. 在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是( )
在实验室中,用如图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中.实验结果与预测的现象一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
| A. | 氢氧化钠 | 明矾溶液 | 开始时即产生白色沉淀 |
| B. | 浓硫酸 | 铜片 | 产生无色气体,溶液变蓝 |
| C. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| D. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 开始时无明显现象 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化钠少量时先生成氢氧化铝,氢氧化钠过量生成偏铝酸钠;
B.浓硫酸和铜在加热条件下反应;
C.浓硝酸和铝发生钝化反应;
D.稀盐酸先与氢氧化钠发生中和,与碳酸钠反应生成碳酸氢钠.
解答 解:A.氢氧化钠少量时先生成氢氧化铝,氢氧化钠过量生成偏铝酸钠,则可观察到开始时即产生白色沉淀,故A正确;
B.浓硫酸和铜在加热条件下反应,常温下不反应,不能观察到产生无色气体,溶液变蓝等现象,故B错误;
C.浓硝酸和铝发生钝化反应,不能观察到产生红棕色气体,故C错误;
D.稀盐酸先与氢氧化钠发生中和,与碳酸钠反应生成碳酸氢钠,则开始时无明显现象,故D正确.
故选AD.
点评 本题综合考查化学实验方案的评价,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价以及物质的性子的异同,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.在pH=1的酸溶液和pH=13的氢氧化钠溶液中,分别加入过量的铝粉,若酸溶液放出的氢气多,其可能的原因是( )
| A. | 两溶液体积相同,酸是多元强酸 | |
| B. | 两溶液体积相同,酸是弱酸 | |
| C. | 酸是强酸,且酸溶液的浓度是碱溶液浓度的3倍以上 | |
| D. | 酸是强酸,且酸溶液的体积是碱溶液体积的3倍以上 |
16.将少量SO2气体通入BaCl2和FeCl3的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生.针对上述变化,下列分析正确的是( )
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO3 | ||
| C. | 该实验表明FeCl3有还原性 | D. | 反应后溶液酸性增强 |
6.有机物M的结构简式如图所示,下列说法正确的是( )


| A. | 分子式为C17H18O3 | |
| B. | M中有4个饱和碳原子 | |
| C. | M可以使溴水和酸性高锰酸钾溶液褪色,但它们的反应类型不同 | |
| D. | 1mol M常温下最多可以与6 mol H2反应 |
13.下列离子方程式正确的是( )
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO4 2-+S↓+H2O | |
| C. | 10 mL 0.1 mol/L FeI2溶液与标况下0.224L Cl2:Fe2++Cl2=2Cl-+2Fe3+ | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
10.下列有关实验操作、现象和解释或结论都正确的是( )
| 实验操作 | 现象 | 解释或结论 |
| 在稀硝酸中加入过量的铁粉,充分反应后滴入KSCN溶液 | 溶液呈红色 | HNO3将Fe氧化为Fe3+ |
| AgI沉淀中滴入KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
15.下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
| A. | C5H10和C6H6 | B. | C2H6和C2H4O2 | C. | C3H6和C3H8 | D. | C2H6和C3H8 |
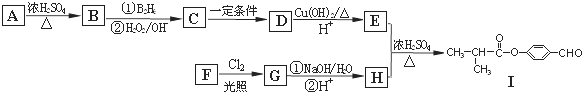
 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为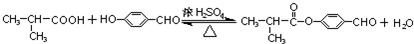 .
. HClO+H++Cl-、HClO
HClO+H++Cl-、HClO H++ClO-、Cl2(g)
H++ClO-、Cl2(g) Cl2(aq).
Cl2(aq).