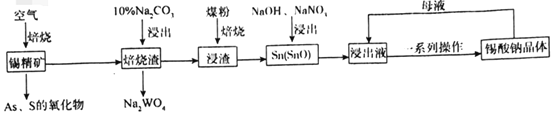
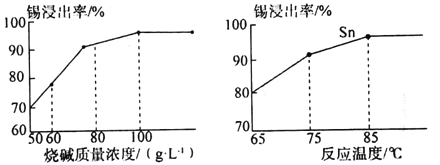
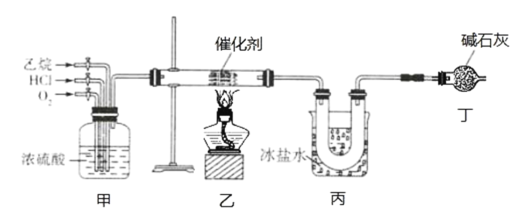
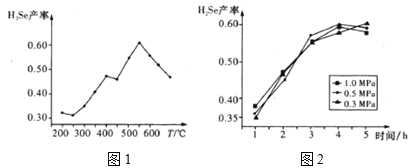
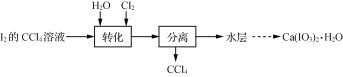
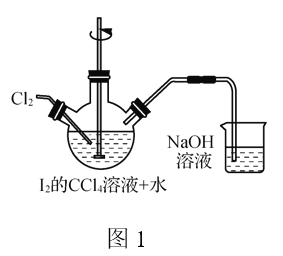
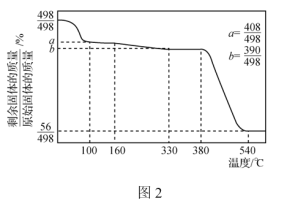
题目内容
【题目】用铅蓄电池进行电絮凝净水是水净化方面的一项研究课题,其工作原理如图所示,下列叙述正确的是( )

A.Y的电极反应:PbO2+2e-+SO42-+4H+=PbSO4+2H2O
B.铅蓄电池工作时H+向X极移动
C.电解池的总反应本质为电解水
D.每消耗103.5gPb,理论上电解池阴极上有11.2LH2生成
【答案】A
【解析】
在电解池的铁电极,发生反应2H2O+2e-=2OH-+H2↑,则铁电极为阴极,铝电极为阳极,从而得出Y电极为正极,X电极为负极。
A.Y为正极,PbO2得电子生成的Pb2+与SO42-结合成PbSO4,氧元素与H+结合成H2O,电极反应为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,A正确;
B.铅蓄电池工作时X极为负极,H+向正极(Y)移动,B不正确;
C.电解池的总反应本质为2Al+6H2O![]() 2Al(OH)3+3H2↑,C不正确;
2Al(OH)3+3H2↑,C不正确;
D.每消耗103.5gPb,转移电子![]() =1mol,理论上电解池阴极上生成0.5molH2,由于未指明是否为标准状况,其体积不一定是11.2L,D不正确;
=1mol,理论上电解池阴极上生成0.5molH2,由于未指明是否为标准状况,其体积不一定是11.2L,D不正确;
故选A。

【题目】在一定温度下,将气体X和气体Y 各0.16mol 充入 10L 恒容密闭容器中,恒容器闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)mol | 0.12 | 0.11. | 0.10 | 0.10 |
A.反应前 2min 的平均速率 v(Z)=2.0×10-3mol·L-1min-1
B.其他条件不变,向平衡体系中再充入0.16mol 气体 X,与原平衡相比,达到新平衡时,气体 Y 的转化率增大,X 的体积分数增大,Z 的体积分数减少
C.其他条件不变,降低温度,反应达到新平衡前 v (逆)>v(正)
D.保持其他条件不变,起始时向溶液中充入0.32mol气体X 和0.32mol 气体 Y,到达平衡时,n(Z)<0.24mol
【题目】下列事实与原因对应关系不正确的是
A | B | C | D | |
物质 |
Na2FeO4 |
海水稻 |
金属铜 |
碳酸钠 |
事实 | 用于自来水净水消毒 | 海水稻的秸杆可以燃烧发电 | Cu作原电池的电极 | 制革工业中原料皮的脱脂 |
主要原因 | Na2FeO4有强氧化性且能在水中产生胶体 | 稻子的秸杆中蕴含生物质能 | Cu能导电且质稳定 | Na2CO3稳定性强 |
A.AB.BC.CD.D