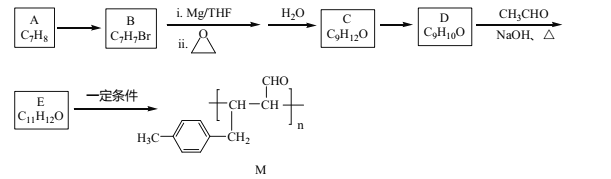
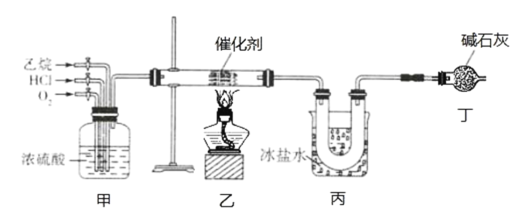
��Ŀ����
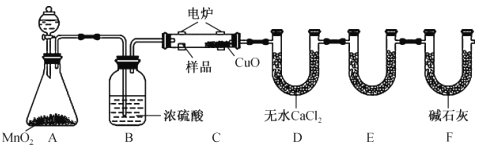
����Ŀ��ijͬѧ��ʵ�����Ա���(�ܶȣ�1.02g.mL��1����Ũ����Ϊԭ���Ʊ�����������(![]() ������Ӧԭ���Լ���Ӧװ��(���ȼ��г�������ʡ�ԣ����£�
������Ӧԭ���Լ���Ӧװ��(���ȼ��г�������ʡ�ԣ����£�
![]() +H2SO4��Ũ��
+H2SO4��Ũ��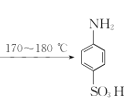 +H2O
+H2O
��֪��100mLˮ��20Cʱ���ܽ����������1.08g����100Cʱ���ܽ�6.67g ��ʵ�鲽�裺
I.��100mL������ƿ�м���10mL������������ʯ����������ƿ������ˮ����ȴ��С�ĵؼ���20mLŨ���
II.��������ƿ���ڼ���װ���л���������170~180�棬ά�ִ��¶�2~2.5h��
III.����ӦҺ��ȴ��Լ50�����ʢ��100mL��ˮ���ձ��У��ò��������Ͻ��裬��ʹ�������������ˣ���������ˮϴ�ӣ��õ�����������ֲ�Ʒ��
VI.���ֲ�Ʒ�÷�ˮ�ܽ⣬��ȴ�ᾧ�����ˣ��ռ���Ʒ�����ɵõ�16.2g���������ᡣ
�ش��������⣺
(1)װ���У�x������Ϊ______________ ����������__________________ ��
(2)����II�У�������װ������ ________ (������ԡ������ˮԡ��)װ�á�
(3)����III�У�����������ˮϴ�Ӷ���������ֲ�Ʒ��ԭ����________________ ��
(4)����VI����ȴ�ᾧ�����У�����Һ��ɫ�������__________(��һ��������)��ɫ��
(5)��ʵ���ж���������IJ���Ϊ__________(���������λС��)��
���𰸡����������� �������� ��ԡ ��ˮ�ж�����������ܽ��С ����̿ 85.38%
��������
�Ա�����Ũ���ᷢ��ȡ����Ӧ�õ����������ᣬʵ���з�Ӧ�¶ȸߣ��������������ӷ�ɢʧ����Ҫ���������������������ã���ȴˮӦ�½��ϳ�����Ӧ�¶�Ϊ170~180������Ϊˮԡ���ȵ��¶���ˮ�ķе����ƣ���ѡ����ԡ���ȣ��Ӷ��õ���Ʒ����Ʒ����ϴ�Ӹ��ﴦ�����ɣ��ٸ���![]() �ɼ������������IJ��ʡ�
�ɼ������������IJ��ʡ�
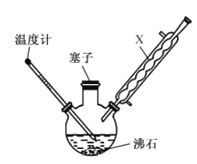
(1)XΪ�������������õ����������ܣ��ɼ��ٶ������������ʧ���ʴ�Ϊ�����������ܣ�����������
(2)���ڷ�Ӧ�¶�Ϊ170~180������ˮԡ���ȵ��¶���ˮ�ķе�(100��)���ƣ���ѡ����ԡ���ȣ��ʴ�Ϊ����ԡ��
(3)������֪������100mLˮ��20Cʱ���ܽ����������1.08g����100Cʱ���ܽ�6.67g�����������������ˮ�е��ܽ��С���ɼ��ٶ����������ܽ���ʧ���ʴ�Ϊ����ˮ�ж�����������ܽ��С��
(4)����̿����������ɫ�أ���ˣ�����ȴ�ᾧ�����У�����Һ��ɫ������û���̿������ɫ���ʴ�Ϊ������̿��
(5)����![]() ���ɵñ���������
���ɵñ���������![]() �����ݷ���ʽ��֪��n(����������)=n(����)���ٸ���
�����ݷ���ʽ��֪��n(����������)=n(����)���ٸ���![]() ���ɵö�������������۲���
���ɵö�������������۲���![]() �������������ʵ�ʲ���Ϊ16.2g����
�������������ʵ�ʲ���Ϊ16.2g����![]() ���ʴ�Ϊ��85.38%��
���ʴ�Ϊ��85.38%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��2018�꣬�����˳��ˡ�����Э����ʵ���ٹ�ҵ��ս�ԣ����й�ȴ�Ӵ��˻������ȣ�����ڹ�����ҹ������εĴ���������ҹ�������ǿ��������CO2���⻯�ϳɼ״������Ĺ�ҵ�������о���ʵ�ֿɳ�����չ��
(1)��֪��I.CO2(g)+H2(g)![]() H2O(g)+CO(g) ��H1=+41.1kJ/mol
H2O(g)+CO(g) ��H1=+41.1kJ/mol
II.CO(g)+2H2(g)![]() CH3OH(g) ��H2=��90.0kJ/mol
CH3OH(g) ��H2=��90.0kJ/mol
д��CO2���⻯�ϳɼ״����Ȼ�ѧ����ʽ:________��
(2)Ϊ���CH3OH�IJ��ʣ�������Ӧ���õ�������________(��ѡ����ĸ����
a.���¸�ѹ b.���µ�ѹ c.���µ�ѹ d.���¸�ѹ
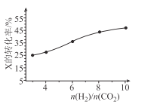
(3)250��ʱ���ں����ܱ���������CO2(g)���⻯�ϳ� CH3OH(g)����ͬͶ�ϱ�[n(H2)/n(CO2)]ʱij��Ӧ��X��ƽ��ת���ʱ仯������ͼ��ʾ����Ӧ��X��_______(����CO2������H2�������ж�������_______��
(4)250��ʱ�������Ϊ2.0 L�ĺ����ܱ������м���6mol H2��2mol CO2�ʹ������� CO2���⻯�ϳɼ״��ķ�Ӧ��10 minʱ��Ӧ�ﵽƽ�⣬���c(CH3OH) = 0.75 mol L-1��
��ǰ10 min�ڵ�ƽ����Ӧ����H2=_______ mol L-1 min-1��
�����¶��£��÷�Ӧ�Ļ�ѧƽ�ⳣ��K =_______��
�������ͷ�Ӧ�����뷴Ӧ��ת���ʺͲ����ѡ���Ը߶���ء�������ͬͶ�ϱȺ���ͬ��Ӧʱ�䣬����ʵ���������±���ʾ��
ʵ���� | �¶�(K) | ���� | CO2ת����(%) | �״�ѡ����(%) |
A | 543 | Cu/ZnO���װ� | 12.3 | 42.3 |
B | 543 | Cu/ZnO����Ƭ | 11.9 | 72.7 |
C | 553 | Cu/ZnO���װ� | 15.3 | 39.1 |
D | 553 | Cu/ZnO����Ƭ | 12.0 | 70.6 |
�����ϱ��������ݣ���CO2�����״�������ѡ��Ϊ________������ĸ����