题目内容
1.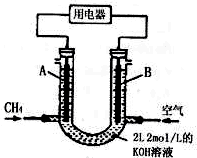 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,应向污水中加入适量的c.
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极发生了两个电极反应,电极反应式是
Ⅰ.Fe-2e-=Fe2+;
Ⅱ.4OH--4e-═2H2O+O2↑
(3)以上电解过程是以上图右侧的燃料电池为电源,该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.
①正极的电极反应是O2+2CO2+4e-=2CO32-;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式是CO2;
(4)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)11.2L.
(5)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性碳棒).持续通入甲 烷,在标准状况下,消耗甲烷体积VL.
①0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O;
②44.8L<V<89.6L时,负极电极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-.
分析 (1)从所加入物质能增大溶液离子浓度,并能保持污水的pH在5.0~6.0之间考虑;
(2)根据电极材料和离子的放电顺序考虑;
(3)①燃料电池中,正极发生的反应是氧气得电子被还原的过程,负极发生的反应是燃料失电子被氧化的过程;
②电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳;
(4)阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,结合转移电子数相等计算;
(5)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.
解答 解:(1)为了增强溶液的导电性,因此可选用易溶性强电解质溶液,排除A和B,考虑到题中要求电解时保持污水的pH在5.0~6.0之间,因此不能添加NaOH,BaSO4不溶,故答案为:c;
(2)电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,同时也发生副反应,即溶液中的OH-失电子被氧化生成O2,故答案为:Fe-2e-=Fe2+;
(3)①料电池中,正极反应一定是氧气得电子,该电池的电解质环境是熔融碳酸盐,所以正极反应为:O2+2CO2+4e-=2CO32-;故答案为:O2+2CO2+4e-=2CO32-;
②电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳;故答案为:CO2;
(4)阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当转移4mol电子时,消耗CH4(标准状况)的体积V=nVm=0.5mol×22.4L/mol=11.2L,故答案为:11.2;
(5)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
①当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,
故答案为:CH4+2O2+2KOH=K2CO3+3H2O;
②当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,
故答案为:CH4-8e-+9CO32-+3H2O=10HCO3-.
点评 本题考查原电池和电解池的知识,做题时注意利用守恒的思考去解答,同时注意电极反应式的书写,涉及的知识点较多,综合性较强,难度较大.

| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 标准状况下,9克H2O 含有的分子数为0.5NA | |
| C. | 常温常压下,32g O2和O3的混合气体所含原子数为2NA | |
| D. | 1mol Fe和足量稀盐酸反应,铁失去的电子数为2NA |
| A. | 实验室制氯气,是在加热条件下,二氧化锰固体与稀盐酸反应 | |
| B. | 新制氯水中只含有Cl2和H2O分子 | |
| C. | 随着氯元素化合价的升高,氯的含氧酸的酸性逐渐增强 | |
| D. | 氯气可用作消毒剂和漂白剂,是因为氯气分子具有强的氧化性 |
| A. | 气态氢化物的稳定性:D>C | B. | 原子序数:b>a>c>d | ||
| C. | 离子的还原性:cCn->dD(n+1)- | D. | 离子的氧化性:aAn+>bB(n+1)+ |
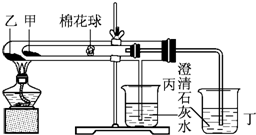 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题: 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题. 有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.
有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.
 ;②中离子方程式为Br-+Ag+═AgBr↓;
;②中离子方程式为Br-+Ag+═AgBr↓;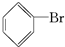 、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗;
、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗; ;
;
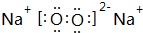 ,指出该化合物中的化学键离子键、非极性共价键.
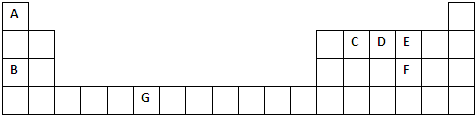
,指出该化合物中的化学键离子键、非极性共价键. (6)请写出元素G的基态原子电子排布式1s22s22p63s23p63d54s1.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(6)请写出元素G的基态原子电子排布式1s22s22p63s23p63d54s1.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: