题目内容
16.为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
(1)装置Ⅰ中①的化学方程式为2Fe+3Br2═2FeBr3,
 ;②中离子方程式为Br-+Ag+═AgBr↓;
;②中离子方程式为Br-+Ag+═AgBr↓;(2)①中长导管的作用是导气兼冷凝回流;
(3)烧瓶中生成的褐色油状液滴的成分是
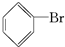 、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗;
、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗;(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.
a的作用是防止倒吸;b中的试剂是CCl4或
 ;
;比较两套装置,装置Ⅱ的主要优点是可以控制反应进行;避免杂质干扰;防止污染空气.
分析 (1)溴与铁反应生成溴化铁,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢;溴离子与银离子生成了溴化银沉淀;
(2)长导管让挥发出来的溴单质冷凝,防止对产物的干扰;
(3)反应生成的溴苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液;
(4)支管是短进短出a的作用是防止倒吸安全装置;B中要除去Br2,b中试剂为苯或四氯化碳.
解答 解:(1)因溴与铁反应生成溴化铁:2Fe+3Br2 ═2FeBr3,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢:C6H6+Br2 $\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;②中反应的离子方程式为Br-+Ag+═AgBr↓,
故答案为:2Fe+3Br2═2FeBr3, ;Br-+Ag+═AgBr↓;
;Br-+Ag+═AgBr↓;
(2)反应为放热反应,长导管让挥发出来的溴单质冷凝,防止对产物的干扰,即长导管的作用为导气,冷凝回流,
故答案为:导气兼冷凝回流;
(3)反应生成的溴苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液,
故答案为: 与Br2;NaOH溶液(或水);分液漏斗;
与Br2;NaOH溶液(或水);分液漏斗;
(4)从图上信息可知,支管是短进短出a的作用是防止倒吸安全装置;B中要除去Br2,试剂为苯或四氯化碳,该装置的优点是:可以控制反应进行;避免杂质干扰;防止污染空气,故答案为:防止倒吸;CCl4或 ;可以控制反应进行;避免杂质干扰;防止污染空气.
;可以控制反应进行;避免杂质干扰;防止污染空气.
点评 本题主要考查了苯的性质实验,掌握反应的原理、各物质的性质以及操作的方法是解题的关键,题目难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
7.下面叙述中正确的是( )
| A. | 1mol冰中有4NA个氢键 | |
| B. | 12克石墨中C---C键为2NA | |
| C. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 | |
| D. | 六方最密堆积中,每个原子的配位数是12 |
4.今有如下三个热化学方程式:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=a kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=b kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1
下列关于它们的表述正确的是( )
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=a kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=b kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol-1
下列关于它们的表述正确的是( )
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 | ||
| C. | 反应热的关系:2b=c | D. | 反应热的关系:a=b |
11.下列化合物中一定不含离子键的是( )
| A. | NaOH | B. | K2CO3 | C. | Na2O | D. | H2SO4 |
8.如果已知100个氧分子质量为m克,那么阿伏加德罗常数的值是( )
| A. | $\frac{3200}{m}$ | B. | $\frac{32}{100m}$ | C. | 3200m | D. | $\frac{m}{3200}$ |
5.自来水常用氯气消毒.用自来水配制下列物质的溶液,药品不会明显变质的是( )
| A. | AgNO3 | B. | FeCl2 | C. | NaOH | D. | AlCl3 |
6.请分析、比较以下几组化学反应,得出结论.
| 组别 | 化学方程式 | 结论 |
| I | 6CO2+6H2O═C6H12O6+6O2 CO2+H2O═H2CO3 | 反应物相同,生成物不同, 原因反应条件不同. |
| Ⅱ | Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O | 反应物相同,生成物不同, 原因反应物的浓度不同. |
| Ⅲ | C+O2(充足)$\frac{\underline{\;点燃\;}}{\;}$CO2 2C+O2(不充足)$\frac{\underline{\;点燃\;}}{\;}$2CO | 反应物相同,生成物不同, 原因反应物的量不同. |
| Ⅳ | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑(反应缓慢) 2KClO3 $→_{加热}^{二氧化锰}$2KCl+3O2↑(反应迅速) | 反应物相同,反应速率不同, 原因有无催化剂. |
| 实践与应用 | 科学探究正努力实现对化学反应的控制,很多化学家致力于研究二氧化碳的“组合转化”技术,把过多二氧化碳转化为有益于人类的物质.若让二氧化碳和氢气在一定条件下反应,可生成一种重要的化工原料,反应的化学方程式如下: 2CO2+6H2$\frac{\underline{\;催化剂\;}}{△}$X+4H2O,推断X的化学式是C2H4. | |
 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.