题目内容
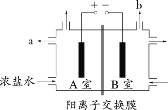
【题目】以氮气和水蒸气为原料,电化学合成氨装置(电极不参与反应)示意图如下。下列说法不正确的是
A.电极 a 连接电源的正极
B.OH向电极 a 迁移
C.总反应:2N2+6H2O(g)![]() 4NH3+3O2
4NH3+3O2
D.电极 b 的电极反应:N2+6e+6H+==2NH3
【答案】D
【解析】
根据图示,a电极生成O2,是熔融电解质中的OH-失去电离生成的,OH-失去电子,发生氧化反应,电极方程式为4OH--4e-=O2↑+2H2O,发生氧化反应,电极a为阳极;电极b上,N2得到电子,转化为NH3,电极方程式为N2+6e-+6H2O=2NH3+6OH-,发生还原反应,则电极b为阴极。
A.根据分析,a是阳极,连接电源的正极,A正确,不选;
B.电解池中,阴离子向阳极移动,则OH-向电极a移动,B正确,不选;
C.总反应为N2和H2O反应生成O2和NH3,总反应方程式为2N2+6H2O(g)![]() 4NH3+3O2,C正确,不选;
4NH3+3O2,C正确,不选;
D.根据分析电极b的电极反应为N2+6e-+6H2O=2NH3+6OH-,D错误,符合题意;
答案选D。

【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据(已知![]() 为阿伏伽德罗常数的值):
为阿伏伽德罗常数的值):
试管中所加试剂及其用量/mL | 溶液退至无色所需时间/min | |||||
实验编号 | 实验温度/℃ | 0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/LKMnO4溶液 | |
① | 25 | 3.0 | v1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | v2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式:___,当该反应以实验①中数据反应完全时转移电子数为_____![]() 。
。
(2)实验①②是探究浓度对反应速率的影响,实验②③时探究温度对反应速率的影响,则表中V1=_______,V2=__________。
(3)根据实验①、②的数据,可以得到的结论是____。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据上述信息提出了新的假设,并设计一下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/ml | 再加入某种固体 | 溶液退至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 3 mol/LH2SO4溶液 | 0.05 mol/L KMnO4 溶液 | ||||
④ | 25 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的新假设是__________。
②若该小组同学提出的假设成立,应观察到__________(填实验现象)。
【题目】下列实验不能达到实验目的的是( )
序号 | 实验操作 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
C | 测定等物质的量浓度的H2CO3、H2SO4溶液的pH | 比较碳、硫的非金属性强弱 |
D | Fe、Cu分别放入相同浓度的盐酸中 | 比较铁、铜的金属性强弱 |
A.AB.BC.CD.D
【题目】氢气是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)为探究实验室制取氢气的合适条件,探究学习小组用如图所示装置制取氢气。

①仪器b的名称是___,若用锌粒和3molL-1H2SO4制取氢气可选用上述仪器中的___(填字母序号)组成氢气的制备和收集装置。
②实验测得H2的生成速率如图2所示:
根据t1~t2时间速率变化判断该反应是___反应(填“吸热”或“放热”)。t2~t3时间速率变化的主要原因是___。
③若用锌粉代替锌粒进行实验,氢气的生成速率明显加快的原因是___。
(2)已知:化学键的键能是指气态原子间形成1mol化学键时释放的能量。几种化学键的键能如下表所示:
键能(kJmol-1) | |
H-H | 436 |
S=S | 255 |
H-S | 339 |
1molS2(g)与足量H2完全反应生成H2S,放出___kJ的热量。
(3)以H2为原料设计成氢氧燃料电池,电池的构造如图3所示,下列说法正确的是___(在原电池中发生氧化反应的电极称为负极)。
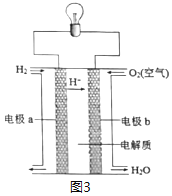
A.电极b是该电池的正极 B.该电池的能量转化率可达100%
C.可用蔗糖溶液作电解质溶液 D.供电时的总反应为:2H2+O2=2H2O