��Ŀ����
����Ŀ����A��B��C��D��E���ֶ���������Ԫ�أ�ԭ��������A��E������AԪ�������������Ǵ�����������2������B�������Ӻ�C������������ԭ�ӵĵ��Ӳ�ṹ��ͬ������ͨ��״���£�B�ĵ��������壬0.1mol B��������������������ȫ��Ӧ����0.4mol����ת�ƣ���C�ĵ����ڵ�ȼʱ��B�ĵ��ʳ�ַ�Ӧ�����ɵ���ɫ�Ĺ��壬�˵���ɫ��������AB2��Ӧ������B�ĵ��ʣ���D����̬�⻯��������ۺ�������ܷ���������ԭ��Ӧ����д����
��1��AԪ�ص����������Ľṹʽ��BԪ�������ڱ��е�λ�� ��
��2��C������B������ȼ�յ���������������ѧ����������C��D ���γɻ�����ĵ���ʽ ��
��3��DԪ�صĵͼ���������E�ĵ��ʵ�ˮ��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��4��Ԫ��D��Ԫ��E��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ��������ѡ����ţ��� a��������D�ĵ��ʺ�E�ĵ���״̬��ͬ b��E���⻯���D���⻯���ȶ�
c��һ��������D��E�ĵ��ʶ������Ʒ�Ӧ d��D����ۺ�������������E����ۺ�����
e��D�ĵ�������E���⻯�ﷴӦ����E���ʣ�
���𰸡�
��1��O=C=O���ڶ����ڵڢ�A��
��2�����Ӽ����Ǽ��Թ��ۼ����ۼ�����![]()
��3��SO2+Cl2+2H2O=H2SO4+2HCl
��4��Cl��bd
���������⣺��A��B��C��D��E���ֶ���������Ԫ�أ�ԭ��������A��E������A�������������Ǵ�����������2������Aԭ����2�����Ӳ㣬����������Ϊ4����AΪ̼Ԫ�أ�B�������Ӻ�C������������ԭ�ӵĵ��Ӳ�ṹ��ͬ����C���ڵ������ڡ�B���ڵڶ����ڣ���ͨ��״���£�B�ĵ��������壬0.1molB��������������������ȫ��Ӧ����0.4mol����ת�ƣ�BԪ�ر��֩�2�ۣ���BΪOԪ�أ�C�ĵ����ڵ�ȼʱ��B�ĵ��ʳ�ַ�Ӧ�����ɵ���ɫ�Ĺ��壬�˵���ɫ��������AB2��Ӧ������B�ĵ��ʣ���CΪNa��D����̬�⻯��������ۺ�������ܷ���������ԭ��Ӧ��E��ԭ�����������DΪSԪ�أ�EΪCl����1��AΪ̼Ԫ�أ����������ΪCO2 �� �ṹʽΪO=C=O��BΪ��Ԫ�أ������ڱ��е�λ���ǵڶ�����VIA�壬���Դ��ǣ�O=C=O���ڶ�����VIA�壻��2��B������C�����ڵ�ȼʱ��Ӧ��������ΪNa2O2 �� �������Ӽ������ۼ���C��D ���γɻ����������ƣ������Ӽ��������ʽΪ ![]() �����Դ��ǣ����Ӽ����Ǽ��Թ��ۼ����ۼ�����
�����Դ��ǣ����Ӽ����Ǽ��Թ��ۼ����ۼ����� ![]() ����3��DԪ�صĵͼ�������Ϊ����������������ˮ��Һ��Ӧ�����ӷ���ʽΪSO2+Cl2+2H2O=H2SO4+2HCl�� ���Դ��ǣ�SO2+Cl2+2H2O=H2SO4+2HCl����4��ͬ�����������Ԫ�طǽ�������ǿ���ʷǽ�����Cl��S��a������״̬�����������ʣ����ܱȽ�Ԫ�طǽ����ԣ���a����b���⻯���ȶ�����Ԫ�طǽ�����һ�£��Ȼ���������ȶ���˵���ȵķǽ����Ը�ǿ����b��ȷ��c�����۽�����Ӧ���Ը��ݲ����н������ϼ��жϷǽ���Ԫ�صķǽ�����ǿ����Na���DZ�۽����������ж������ȵķǽ�����ǿ������c����d����ۺ����������������Ԫ�صķǽ�����һ�£���d��ȷ��e��������HCl��Ӧ������������e�������Դ��ǣ�Cl��bd��
����3��DԪ�صĵͼ�������Ϊ����������������ˮ��Һ��Ӧ�����ӷ���ʽΪSO2+Cl2+2H2O=H2SO4+2HCl�� ���Դ��ǣ�SO2+Cl2+2H2O=H2SO4+2HCl����4��ͬ�����������Ԫ�طǽ�������ǿ���ʷǽ�����Cl��S��a������״̬�����������ʣ����ܱȽ�Ԫ�طǽ����ԣ���a����b���⻯���ȶ�����Ԫ�طǽ�����һ�£��Ȼ���������ȶ���˵���ȵķǽ����Ը�ǿ����b��ȷ��c�����۽�����Ӧ���Ը��ݲ����н������ϼ��жϷǽ���Ԫ�صķǽ�����ǿ����Na���DZ�۽����������ж������ȵķǽ�����ǿ������c����d����ۺ����������������Ԫ�صķǽ�����һ�£���d��ȷ��e��������HCl��Ӧ������������e�������Դ��ǣ�Cl��bd��

 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ���֡�
���� ���ڡ����� | ��A | ��A | ��A | ��A | ��A | ��A | ��A |
1 | �� | ||||||
2 | �� | �� | |||||
3 | �� | �� | |||||
4 | �� | �� | |||||
(1)����Ԫ��________(��дԪ�ط���)�ķǽ�������ǿ��Ԫ��________(��дԪ�ط���)�Ľ�������ǿ��д������ˮ��Ӧ�����ӷ���ʽ__________________________________��
(2)����Ԫ�آ۵�ԭ�ӽṹʾ��ͼ��________��
(3)����Ԫ�آޡ����⻯����ȶ���˳��Ϊ________>________(��д��ѧʽ����ͬ)��
(4)����Ԫ������������Ӧˮ����������ǿ����ķ���ʽ��_________________��
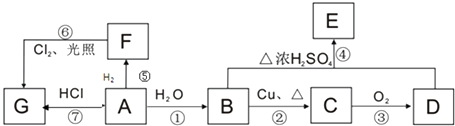
����Ŀ��A��B��C��D��E��F���ֻ��������A��B��C��D��E���ɶ�����Ԫ����ɣ���ɫ��Ӧ��Ϊ��ɫ��B��C��E��������Ԫ����ɣ�B��C�����Ԫ����ͬ����C��Ħ��������B��80g/mol���ش�
��1�����廯����AΪdz��ɫ��ĩ���û������к��еĻ�ѧ��Ϊ_______
A.���Ӽ� B.���Թ��ۼ� C.�Ǽ��Թ��ۼ� D.���
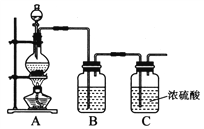
��2���±�ΪB��Fʵ��IJ�������
���ں�B����Һ�м���ϡH2SO4������dz��ɫ���Ǻ�ʹ����ʯ��ˮ����ǵ���ɫ�д̼�����ζ������ |
��20mL��ˮ�еμ�F�ı�����Һ1��2mL����Һ��ʺ��ɫ�����ü���������ж����ЧӦ�� |
д��B��ϡH2SO4��Ӧ�����ӷ���ʽ________
д�����з�Ӧ�Ļ�ѧ����ʽ________
��3������6������Mn2+��MnO 4-��H+��H2O��X2Y 82-��C�к��е������ӣ���XY 42-���һ�����ӷ���ʽ����֪Mn2+Ϊ��ԭ�����õ�1mol MnO 4- �������������ʵ���Ϊ________ mol
��4��������D��E�ת��D ![]() E������D��ExH2O�Ļ����13.04g�����ȵ���ȫ��Ӧ���������ͨ��ŨH2SO4����3.42g��ʣ������ͨ����ʯ������2.20g����������D������Ϊ________ g��ExH2O�Ļ�ѧʽΪ________��
E������D��ExH2O�Ļ����13.04g�����ȵ���ȫ��Ӧ���������ͨ��ŨH2SO4����3.42g��ʣ������ͨ����ʯ������2.20g����������D������Ϊ________ g��ExH2O�Ļ�ѧʽΪ________��
����Ŀ�������ʾΪ��Ȼ���еĶ���ͭ��ʯ����Ҫ�ɷ֣�
��ʯ���� | ��ͭ�� | ��ͭ�� | ��ͭ�� | ��ȸʯ |
��Ҫ�ɷ� | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3Cu��OH��2 |
��ش�
��1���ϱ�����ͭ�������У�ͭ�������ٷֺ�����ߵ������ѧʽ��
��2����ҵ���Ի�ͭ��Ϊԭ�ϣ����û�������������ͭ���ù��յ��м���̰�����Ӧ�� 2Cu2O+Cu2S ![]() 6Cu+SO2������÷�Ӧ���������뻹ԭ�������ʵ���֮����
6Cu+SO2������÷�Ӧ���������뻹ԭ�������ʵ���֮����
��3����������������ͭ��β��ֱ���ŷŵ���������ɻ�����Ⱦ�ĺ������������β���ɵõ��м�ֵ�Ļ�ѧƷ��д������һ�����һ���ε����ƻ�ѧʽ�� ��
��4���±��У��Գ��������ȷ�Լ������������ϵ���ж϶���ȷ����������ĸ����
ѡ�� | ������ | ������ | �ж� |
A | ͭ�̵����ɷ��Ǽ�ʽ����ͭ | ����ϡ�����ͭ�������ͭ�� | ��ԣ���ԣ��� |
B | ͭ�����γ����ܵ�����Ĥ | ͭ��������ʢ��Ũ���� | ��ԣ���ԣ��� |
C | ����ͭ���� | í��ͭ���ϵ������ڳ�ʪ�����в������� | ��ԣ���ԣ��� |
D | ��ɫ����ͭ��������ת��Ϊ��ɫ����ͭ��ĩ�������仯 | ����ͭ��Һ��������Ӿ�ص������� | �������ԣ��� |