题目内容
5.如图下列表述不正确的是( )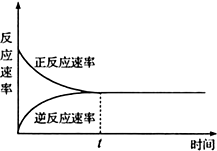
| A. | t时刻表示在给定条件下该反应在达到最大限度 | |
| B. | t时刻表示该反应达到化学平衡状态 | |
| C. | t时刻以前正反应速率大于逆反应速率 | |
| D. | t时刻及以后正反应速率等于逆反应速率等于0 |
分析 由图象可知,t时刻反应到达平衡,之前均为υ(正)>υ(逆),从t时刻后均为υ(正)=υ(逆)≠0,但该限度是有条件的,如果外界条件改变,限度被破坏,从而达到新的限度,以此来解答.
解答 解:A.t时刻反应到达平衡,可逆反应达到平衡状态时,正逆反应速率相等,反应达到最大限度,故A正确;
B.可逆反应达到平衡状态时,正逆反应速率相等,但不等于0,故B正确;
C.t时刻反应到达平衡,之前均为υ(正)>υ(逆),故C正确;
D.达到平衡状态,正逆反应速率相等但不是0,为动态平衡状态,故D错误;
故选D.
点评 本题考查反应速率-时间图象,注意理解化学平衡的建立与平衡状态特征,明确化学平衡状态特点是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列物质中,不属于合金的是( )
| A. | 18K金 | B. | 青铜 | C. | 钢 | D. | 水银 |
16.已知①氢硫酸是二元弱酸,②CuSO4+H2S═CuS↓+H2SO4.在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4.能使溶液中的c(H+)增大的是( )
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ① |
20.下列物质中不能使高锰酸钾酸性溶液褪色的是( )
| A. | 丙烯 | B. | 苯 | C. | 甲苯 | D. | 乙炔 |
10.下列变化中,需要加入氧化剂才能实现的是( )
| A. | KCl→AgCl | B. | Cl2→NaClO | C. | SiO2→Si | D. | Cu→CuSO4 |
17.下列离子方程式正确的是( )
| A. | 大理石与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 将少量铜片放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 向澄清石灰水中加入过量的小苏打溶液:OH-+HCO3-+Ca2+═CaCO3↓+H2O |
4.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁能源 | |
| C. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化的过程 | |
| D. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
 和
和 ⑧CH3CH2CH2CH3 和CH3CH2CH(CH3)2
⑧CH3CH2CH2CH3 和CH3CH2CH(CH3)2