题目内容
4.化学与生产和生活密切相关,下列说法正确的是( )| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁能源 | |
| C. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化的过程 | |
| D. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
分析 A.聚乙烯塑料是乙烯发生加成反应生成的高分子聚合物,聚乙烯的单体是乙烯;
B.煤的气化、液化都是化学变化;
C.淀粉→葡萄糖→乙醇都是化学变化;
D.碳纤维是碳的单质.
解答 解:A.乙烯含碳碳双键其中1根键断裂,相互加成生成聚乙烯,聚乙烯中不存在双键,聚乙烯塑料的老化是由于长链断裂等原因,故A错误;
B.煤的气化是煤在氧气不足的条件下进行部分氧化形成H2、CO等气体的过程,煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品的过程,所以煤经过气化和液化等变化是化学变化,故B错误;
C.用粮食酿酒时,先在糖化酶作用下水解为葡萄糖,然后在酵母作用下转变为酒精,都是化学变化,故C正确;
D.合成纤维、人造纤维都属于有机高分子材料,碳纤维是碳的单质,不属于有机高分子材料,故D错误;
故选C.
点评 本题主要考查了生活的化学相关的知识,掌握塑料的老化、煤的气化和液化、有机高分子材料、粮食酿酒等知识是解答的关键,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
5.如图下列表述不正确的是( )
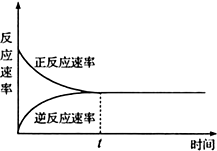

| A. | t时刻表示在给定条件下该反应在达到最大限度 | |
| B. | t时刻表示该反应达到化学平衡状态 | |
| C. | t时刻以前正反应速率大于逆反应速率 | |
| D. | t时刻及以后正反应速率等于逆反应速率等于0 |
6.下列说法正确的是( )
| A. | 葡萄糖与果糖、淀粉与纤维素均互为同分异构体 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 | |
| D. | C3H8的二氯代物共有3种 |
3.下列各组表示式的意义相同的是( )
| A. | -NO2,NO2 | B. | HCOOCH3,CH3OCHO | C. | HCOO-,-COOH | D. | C2H5OH,CH3OCH3 |
10.某化学反应2A?B+D在四种不同条件下进行.B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20min时间内平均速率为0.013mol•(L•min)-1.
(2)在实验2中,A的初始浓度c2=1.0mol/L,反应经20min就到达平衡,可推测实验2中还隐含的条件是加入催化剂.
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 820℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,反应在10至20min时间内平均速率为0.013mol•(L•min)-1.
(2)在实验2中,A的初始浓度c2=1.0mol/L,反应经20min就到达平衡,可推测实验2中还隐含的条件是加入催化剂.
9.下列说法不正确的是( )
| A. | 同系物的化学性质相似 | |
| B. | 同位素的化学性质几乎相同 | |
| C. | 相对分子质量相同的化合物,互称同分异构体 | |
| D. | 同素异形体之间的转化,同分异构体之间的转化都属于化学变化 |
16.下列说法正确的是( )
| A. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 | |
| C. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)?H<0,则该反应一定不能自发进行 | |
| D. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
13.煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应的化学方程式为:CO(g)+2H2(g)?CH3OH(g)
(1)下列描述中能说明上述反应已达平衡的是AC;
A.容器内气体的平均摩尔质量保持不变
B.2v(H2)正=v(CH3OH)逆
C.容器中气体的压强保持不变
D.单位时间内生成nmol CO的同时生成2nmol H2
(2)在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4min时候达到其限度,此时容器中压强与反应前之比为3:5,容器内物质的各种物质的量浓度如下表:
则b=0.100
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如图所示,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l),则负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+,如果该电池工作时电路中通过1.2mol电子,则消耗CH3OH有0.2mol.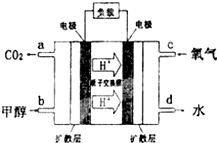
(1)下列描述中能说明上述反应已达平衡的是AC;
A.容器内气体的平均摩尔质量保持不变
B.2v(H2)正=v(CH3OH)逆
C.容器中气体的压强保持不变
D.单位时间内生成nmol CO的同时生成2nmol H2
(2)在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4min时候达到其限度,此时容器中压强与反应前之比为3:5,容器内物质的各种物质的量浓度如下表:
| 时间/浓度 | c(CO)(mol/L) | c(H2)(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4min | a | b | c |
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如图所示,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l),则负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+,如果该电池工作时电路中通过1.2mol电子,则消耗CH3OH有0.2mol.

14.已知胆矾溶于水时溶液的温度降低,胆矾分解的热化学方程式为:CuSO4•5HO2(s)═CuSO4(s)+5H2O(I)1J/mol,室温时若将1mol无水CuSO4溶液时放热Q2J,则( )
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法比较 |