题目内容
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 (填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是 ;
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是
(请用相应的编号字母填写);
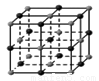
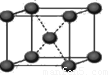
A B C D E
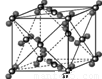
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
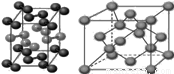
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
(1)1S22S22P4 (1分) (2)H2S、NH2-(2分) (3)A (1分) (4)BC (2分)
(5)20 (1分) (6)Cu2++4H2O=[Cu(H2O)4]2+(1分)
【解析】
试题分析:(1)氧原子的核电荷数是8,根据构造原理可知外围电子有6个电子,2s能级上有2个电子,2p能级上有4个电子,所以水分子中氧原子在基态时核外电子排布式为1S22S22P4。
(2)原子个数相等、价电子数相等的微粒为等电子体。水分子含有3个原子、8个价电子,因此与水互为等电子体的微粒有:H2S、NH2-。
(3)A、水分子中氧原子含有2个共价单键和2个孤电子对,其空间构型是V型,所以水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A不正确B、水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B合理;C、因结构不同,则性质不同,微粒的化学性质发生了改变,故C合理;D、水分子为V型,键角是104.5°。H3O+为三角锥型,微粒中的键角发生了改变,故D合理,因此答案为:A;
(4)冰属于分子晶体,根据微粒的晶胞结构特点可知,A是离子晶体氯化钠的晶胞,构成微粒是离子。B为干冰的晶胞图,构成微粒为分子,属于分子晶体。C为碘的晶胞图,构成微粒为碘分子,所以分子晶体;D是原子晶体金刚石的晶胞,构成微粒是原子。E是金属晶体钠的晶胞,构成微粒是金属阳离子和自由电子,则与冰的晶体类型相同的是干冰和碘单质,故答案为:BC。
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,则根据结构图 可知,1mol水中含有2mol氢键,升华热=范德华力+氢键。由于冰的升华热是51kJ/mol,水分子间的范德华力是11kJ/mol,所以冰晶体中氢键的“键能”是(51kJ/mol-11kJ/mol)÷2=20kJ/mol。
可知,1mol水中含有2mol氢键,升华热=范德华力+氢键。由于冰的升华热是51kJ/mol,水分子间的范德华力是11kJ/mol,所以冰晶体中氢键的“键能”是(51kJ/mol-11kJ/mol)÷2=20kJ/mol。
(6)无水硫酸铜溶于水后生成水合铜离子,铜离子提供空轨道,水分子中的氧原子提供孤电子对,形成配位键,该配合离子的结构: ,生成此配合离子的离子方程式Cu2++4H2O=[Cu(H2O)4]2+。
,生成此配合离子的离子方程式Cu2++4H2O=[Cu(H2O)4]2+。
考点:考查核外电子排布、等电子体、化学键、杂化轨道类型、分子空间结构、晶胞结构、氢键、配位健

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案(1)水分子中氧原子在基态时核外电子排布式为
(2)H2O分子中氧原子采取的是
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体
类型相同的是
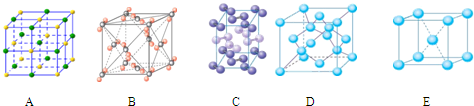
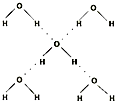
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:
(7)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
(8)分析下表数据,请写出你的最具概括性的结论:
| 键型 | 键能 (kJ/mol) |
键长 (pm) |
分子 | 键角 | 物质 | 熔点(℃) | 沸点(℃) |
| H-C | 413 | 109 |  |
109.5° | 甲烷 | -183.7 | -128.0 |
| H-N | 391 | 101 | 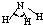 |
107° | 氨 | -77.7 | -33.3 |
| H-O | 467 | 96 | 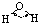 |
104.5° | 水 | 0.0 | 100.0 |