题目内容
氮是地球上极为丰富的元素
(1)Li3N晶体中氮以N3-的形式存在,基态N3-的电子排布式为
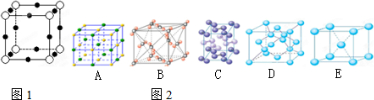
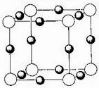
(2)X离子中所有电子正好充满K.L.M三个电子层,它与N3-形成的晶体结构如图1所示.X的元素符号是
(3)水 是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(为按顺序排序).与冰的晶体类型相同的是
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51kJ/mol,除分子间还存在范德华力(11kJ/mol)则冰晶体中氢键的“键能”是
(1)Li3N晶体中氮以N3-的形式存在,基态N3-的电子排布式为
1S22S22P6
1S22S22P6
;(2)X离子中所有电子正好充满K.L.M三个电子层,它与N3-形成的晶体结构如图1所示.X的元素符号是
Cu
Cu
,X离子与N3-形成的化合物化学式为Cu3N
Cu3N
.(3)水 是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(为按顺序排序).与冰的晶体类型相同的是
BC
BC
(请用相应的编号填写)(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51kJ/mol,除分子间还存在范德华力(11kJ/mol)则冰晶体中氢键的“键能”是
20
20
kJ/mol
分析:(1)N3-离子原子核外共有10个电子,根据能量最低原理可写出电子排布式;
(2)X+所含电子=2+8+18=28,所以X为29号Cu元素,利用均摊法计算;
(3)冰属于分子晶体,利用晶胞图来判断晶体的构成微粒,以此来分析;
(4)升华热=范德华力+氢键,利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能.
(2)X+所含电子=2+8+18=28,所以X为29号Cu元素,利用均摊法计算;
(3)冰属于分子晶体,利用晶胞图来判断晶体的构成微粒,以此来分析;
(4)升华热=范德华力+氢键,利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能.
解答:解:(1)N原子原子序数为7,N3-离子原子核外共有10个电子,且最外层达到稳定结构,根据能量最低原理可写出电子排布式为1S22S22P6,
故答案为:1S22S22P6;
(2)X+所含电子=2+8+18=28,所以X为29号Cu元素,晶胞中N(Cu)=12×
=3,N(N3-)=8×
=1,则化学式为Cu3N,
故答案为:Cu;Cu3N;
(3)冰属于分子晶体,由晶胞图可知,B为干冰的晶胞图,构成微粒为分子,C为碘的晶胞图,构成微粒为碘分子,则与冰的晶体类型相同的是BC,故答案为:BC;
(4)冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),根据图象知,1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol,故答案为:20.
故答案为:1S22S22P6;
(2)X+所含电子=2+8+18=28,所以X为29号Cu元素,晶胞中N(Cu)=12×
| 1 |
| 4 |
| 1 |
| 8 |
故答案为:Cu;Cu3N;
(3)冰属于分子晶体,由晶胞图可知,B为干冰的晶胞图,构成微粒为分子,C为碘的晶胞图,构成微粒为碘分子,则与冰的晶体类型相同的是BC,故答案为:BC;
(4)冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),根据图象知,1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol,故答案为:20.
点评:本题考查晶胞的计算以及化学键、晶体类型等知识,是中等难度的试题,试题基础性强,在注重对吸收基础知识巩固和训练的同时,侧重对学生能力的培养,意在巩固学生的基础,提高学生的答题能力和学习效率.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 、
、
