题目内容
【题目】有关如下反应的叙述正确的是
I :C(g)+H2O(g) ![]() CO(g)+H2(g) △H=+131.0kJ/mol
CO(g)+H2(g) △H=+131.0kJ/mol
II: CO(g) +H2O(g) ![]() CO2(g) + H2(g) △H=-43kJ/mol
CO2(g) + H2(g) △H=-43kJ/mol
III: CaO(s) + CO2(g)![]() CaCO3(s) △H =-178.3 kJ/mol
CaCO3(s) △H =-178.3 kJ/mol
IV: C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g) △H=akJ/mol
CaCO3(s)+2H2(g) △H=akJ/mol
A. a=+90.3
B. 恒温恒压下,在己达平衡的反应I体系中再充入少量He时平衡正向移动
C. 其他条件不变,加压对反应Ⅱ的反应速率无影响
D. 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率
【答案】B
【解析】A.由盖斯定律知反应C(s)+2H2O(g)+CaO(s)CaCO3(s)+2H2(g)的△H等于反应I、Ⅱ、Ⅲ的△H之和,所以反应C(s)+2H2O(g)+CaO(s)CaCO3(s)+2H2(g)的△H=131.0kJ/mol-43kJ/mol-178.3kJ/mol=-90.3kJ/mol,故A错误;B. 恒温恒压下,在己达平衡的反应I体系中再充入少量He时,相当于减小压强,平衡正向移动,故B正确;C. 其他条件不变,增大压强,反应Ⅱ的反应速率无增大,故C错误;D. 其他条件不变,升高温度,反应Ⅲ的平衡逆向移动,CO2的转化率减小,故D错误;故选B。

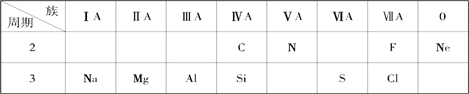
【题目】四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍。元素M与Z同周期,且原子半径是同周期中最大的。元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙。
X | Y | |
Z | W |
请按要求回答下列问题:
(1)X的单质的电子式:_________;W最高价氧化物的水化物的化学式:________________。
(2)M、Z、W分别形成的简单离子的半径由大到小顺序为(填离子符号)__________;写一个能说明元素W比元素Z的非金属性强的化学方程式:____________________。
(3)甲变为乙的化学方程式为_______________________。
(4)常温下,当用200mL 1mol·L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为___________;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为___________________________。
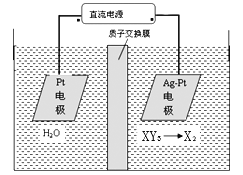
(5) 工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为_______________。