题目内容
【题目】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为_____________
(2)与阴离子(CN-)互为等电子体的两种分子有______________、____________________
(3)氨水溶液中存在多种氢键,任表示出其中两种_________________、_________________.
(4)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因是______________
②硝酸比亚硝酸酸性强的原因是______________

(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的核外电子排布式为_________________与同一个N3-相连的X+有_____ 个。
(6)X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为________________该化学键能形成的原因是___________________请画出[X(H2O)4]2+离子的结构式(用元素符号写结构式)__________________。
【答案】 C<O<N N2 CO O-H…N N-H…O(其他正确形式也给分) 第一步电离生成的负离子较难再进一步电离出带正电荷的H+ 硝酸中非羟基氧是两个,亚硝酸非羟基O是一个,非羟基氧越多酸性越强 ls22s22p63s23p63d104sl 6 配位键 H2O能提供孤对电子,Cu2+能接受孤对电子(或Cu2+有空轨道) 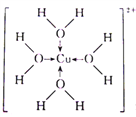
【解析】本题考查配合物的成键情况、电离能、氢键、电子排布式等知识,题目难度中等,注意掌握电离能大小比较方法及配合物的成键情况,明确氢键、电子排布式的表示方法,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力。
(1)C、N、O元素是同一周期相邻元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半充满稳定状态,能量较低,第一电离能高于同周期相邻元素,则第一电离能由小到大的顺序为C<O<N。
(2)根据等电子体的定义,将CN-中C原子及1个负电荷换成1个N原子,可得等电子体N2,将N原子及1个负电荷换成1个O原子,可得等电子体CO。
(3)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N。
(4)①磷酸第一步电离出氢离子后变为阴离子,阴离子难电离出带正电荷的氢离子,所以H3PO4的K1远大于K2,则答案为第一步电离生成的负离子较难再进一步电离出带正电荷的H+;②由于硝酸中非羟基氧是两个,亚硝酸非羟基O是一个,非羟基氧越多酸性越强,所以硝酸比亚硝酸酸性强。
(5)X+中所有电子正好充满K、L、M三个电子层,X原子核外电子数=2+8+18+1=29,则X为Cu元素,Cu元素是29号元素,原子核外电子数为29,核外电子排布式为ls22s22p63s23p63d104sl ;该晶胞中白色小球=8×1/8=1,黑色小球=12×1/4=3,N3-带3个单位负电荷、Cu+带1个单位正电荷,所以形成的化合物为Cu3N,则白色小球表示N3-、黑色小球表示Cu+,则同一个N3-相连的Cu+有6个。
(6)Cu2+有空轨道,能接受孤对电子,H2O能提供孤对电子,所以Cu2+与H2O之间的化学键类型为配位键,原因为H2O能提供孤对电子,Cu2+能接受孤对电子(或Cu2+有空轨道);[X(H2O)4]2+离子为[Cu(H2O)4]2+,[Cu(H2O)4]2+离子中含有配位键,其结构式为: 。
。






