题目内容
【题目】针对下面10种元素,完成以下各小题。
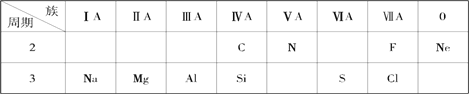
(1)金属性最强的元素是________(填名称);化学性质最不活泼的元素是________(填元素符号)。
(2)S 原子结构示意图为___________;
(3)除Ne以外的其余九种元素的原子中,原子半径最小的是___________(填元素符号);
(4)元素硅的氧化物常用于制造___________(填一种高性能的现代通讯材料的名称);
(5)氮元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型为_______________;氮元素的氢化物与氯元素的氢化物能生成盐W,W的电子式为____________________。
(6)元素最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),呈两性的是_________(填化学式);两者反应的化学方程式__________________________。
【答案】 钠(或钠元素) Ne  F 光导纤维 离子键和共价键
F 光导纤维 离子键和共价键 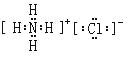 NaOH Al(OH) 3 NaOH + Al(OH) 3= NaAlO2 + 2H2O
NaOH Al(OH) 3 NaOH + Al(OH) 3= NaAlO2 + 2H2O
【解析】(1)根同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性最强的元素处于周期表的左下角,Na元素的金属性最强金属性最强的元素是钠(或钠元素);Ne最外层达到稳定结构,化学性质最不活泼的元素是Ne(填元素符号)。
(2)S为16号元素,有三个电子层,S 原子结构示意图为 ;(3)同周期随原子序数的增大,核电荷数对核外电子引力增大,原子半径减小,同主族从下往上,原子半径减小,除Ne以外的其余九种元素的原子中,原子半径最小的是F(填元素符号);
;(3)同周期随原子序数的增大,核电荷数对核外电子引力增大,原子半径减小,同主族从下往上,原子半径减小,除Ne以外的其余九种元素的原子中,原子半径最小的是F(填元素符号);
(4)元素硅的氧化物SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);(5)氮元素的最高价氧化物对应水化物与其氢化物能生成盐M为NH4NO3,M中含有的化学键类型为离子键(NH4+ 和NO3―)和共价键(N―O和N―H键);氮元素的氢化物与氯元素的氢化物能生成盐W,W的电子式为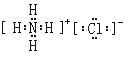 。
。
(6)根同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性最强的元素处于周期表的左下角,Na元素的金属性最强金属性最强的元素是钠,元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH) 3(填化学式);两者反应的化学方程式NaOH + Al(OH) 3= NaAlO2 + 2H2O。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】下列物质的分类组合全部正确的是( )
编组 | 强电解质 | 弱电解质 | 非电解质 |
A | NaCl | H2O | Cl2 |
B | H2SO4 | CaCO3 | CCl4 |
C | AgCl | HClO | Cu |
D | Ba(OH)2 | H2S | C2H5OH |
A. A B. B C. C D. D
