题目内容
【题目】己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线[Ksp(CaSO4)=9×10-6]。下列相关叙述正确的是
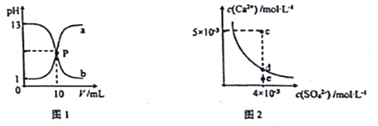
A. 图1中P点溶液:c(Na+)= c(Cl-)>c(H+) = c(OH-)
B. 由图1可知盐酸和NaOH溶液的浓度均为1mol·L-1
C. 图2中c点有沉淀生成,达平衡后溶液中c(SO42-)=3×10-3 mol·L-1
D. 可通过蒸发将图 2中e点的溶液变到d点
【答案】A
【解析】A. 图1中P点溶液显中性,c(Na+)= c(Cl-)>c(H+) = c(OH-),故A正确;B. 温度不一定是常温,则NaOH溶液的浓度不一定为1mol·L-1,故B错误;C. 根据图示数据,可以看出c点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,由于c点c(Ca2+)>c(SO42-),生成沉淀时两者减少的离子数目相同,Ksp(CaSO4)=9×10-6,则平衡后(Ca2+)>c(SO42-),c(SO4-)小于3×l0-3mol/L,故C错误;D. e为不饱和溶液,蒸发时硫酸根的浓度会增大,所以e点溶液通过蒸发不能变到d点,故d错误;故选A。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目






