��Ŀ����
����Ŀ���밴Ҫ��ش������йش�����Ⱦ������������⡣
(1)��������������ʱ�������NO2��������Ҫ��Ӧ�������仯��ͼ��ʾ��
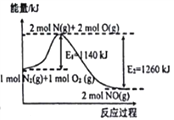
��д��N2��O2��Ӧ���Ȼ�ѧ����ʽ��_______________��
�ڳ�����NH3����NO2ֱ�ӷ�Ӧʵ����ת����д���ô˷�����n(NO)��n(NO2)=1:1ʱ��Ӧ�����棩�Ļ�ѧ����ʽ__________________����֪�÷�Ӧ��H<0��д�����ܼӿ췴Ӧ����������ߵ��������ת���ʵĴ�ʩ֮һ��_________________��
(2)����I2O5����CO��Ⱦ�ķ�ӦΪ��5CO(g)+I2O5(s) ![]() 5CO2(g)+I2(s)����ͬ�¶��£���װ������I2O5�����2L���ݺ����ܱ�������ͨ��2molCO�����CO2�����ʵ�������[��(CO2)]��ʱ��t�仯��������ͼ��ʾ��
5CO2(g)+I2(s)����ͬ�¶��£���װ������I2O5�����2L���ݺ����ܱ�������ͨ��2molCO�����CO2�����ʵ�������[��(CO2)]��ʱ��t�仯��������ͼ��ʾ��
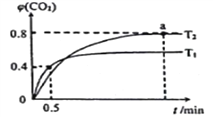
��T1�¶��£�0.5min��CO2��ƽ������Ϊ_______________��
T2�¶��£���ѧƽ�ⳣ��K=_________________��
��a��ʱ�����������ٳ���2molCO���ٴδﵽƽ���(CO2)_______________�����������С�����䡱
(3)����I2����SO2��Ⱦ�Ĺ�ҵ�������£�
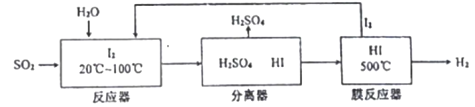
�ٷ�Ӧ���з�Ӧ�����ӷ���ʽ��______________________��
���û�ѧƽ���ƶ���ԭ��������ʹ��Ĥ��Ӧ����ʱ�����H2��Ŀ���ǣ�_________��
���𰸡� N2(g)+O2(g)=2NO(g) ��H=-120kJ��mol-1 2NH3+NO+NO2![]() 2N2+3H2O �����������䣬����NH3Ũ�� 0.8mol��L-1��min-1 1024 ���� SO2+I2+2H2O=SO42-+2I-+4H+ HI�ֽ�Ϊ���淴Ӧ����ʱ��������������������ڷ�Ӧ������У������ɸ����I2����ѭ��ʹ��
2N2+3H2O �����������䣬����NH3Ũ�� 0.8mol��L-1��min-1 1024 ���� SO2+I2+2H2O=SO42-+2I-+4H+ HI�ֽ�Ϊ���淴Ӧ����ʱ��������������������ڷ�Ӧ������У������ɸ����I2����ѭ��ʹ��
��������(1)������ͼ��N2��O2��Ӧ���Ȼ�ѧ����ʽΪN2(g)+O2(g)=2NO(g) ��H=1140 kJ��mol-1-1260 kJ��mol-1=-120kJ��mol-1���ʴ�Ϊ��N2(g)+O2(g)=2NO(g) ��H=-120kJ��mol-1��
��������NH3����NO2ֱ�ӷ�Ӧʵ����ת�������ɵ�����ˮ���ô˷�����n(NO)��n(NO2)=1:1ʱ��Ӧ(����)�Ļ�ѧ����ʽΪ2NH3+NO+NO2![]() 2N2+3H2O���÷�Ӧ��H<0�����ܼӿ췴Ӧ����������ߵ��������ת���ʵĴ�ʩ�����������������䣬����NH3Ũ�ȣ��ʴ�Ϊ��2NH3+NO+NO2
2N2+3H2O���÷�Ӧ��H<0�����ܼӿ췴Ӧ����������ߵ��������ת���ʵĴ�ʩ�����������������䣬����NH3Ũ�ȣ��ʴ�Ϊ��2NH3+NO+NO2![]() 2N2+3H2O�������������䣬����NH3Ũ�ȣ�
2N2+3H2O�������������䣬����NH3Ũ�ȣ�
(2)��ͼ���֪T1�¶��£�0��0.5min�ڶ�����̼�������Ϊ0.3����CO�ı仯��Ϊx��
5CO(g)+I2O5(s)5CO2(g)+I2(s)
��ʼ��(mol/L) 1 0
�仯��(mol/L) x x
5min��(mol/L) 1-x x
![]() =0.4����ã�x=0.4���ɷ�Ӧ����v=
=0.4����ã�x=0.4���ɷ�Ӧ����v=![]() =
=![]() =0.8molL-1min-1�� T2�¶��´ﵽƽ�⣬������̼�������Ϊ0.8����һ����̼ת��y
=0.8molL-1min-1�� T2�¶��´ﵽƽ�⣬������̼�������Ϊ0.8����һ����̼ת��y
5CO(g)+I2O5(s)5CO2(g)+I2(s)
��ʼ��(mol/L) 1 0
�仯��(mol/L) y y
ƽ����(mol/L) 1-y y
![]() =0.8����ã�y=0.8mol/L��ƽ�ⳣ��=
=0.8����ã�y=0.8mol/L��ƽ�ⳣ��=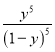 =
= =1024���ʴ�Ϊ��0.8 molL-1min-1��1024��
=1024���ʴ�Ϊ��0.8 molL-1min-1��1024��
��a��ʱ�����������ٳ���2molCO��ƽ�������ƶ������¶Ȳ��䣬ƽ�ⳣ�����䣬����ٴδﵽƽ�����(CO2)���䣬�ʴ�Ϊ�����䣻
(3)��������ͼ��֪���ڷ�Ӧ���У�I2����SO2�����������HI����Ӧ����ʽΪSO2+I2+2H2O=SO42-+2I-+4H+���ʴ�Ϊ��SO2+I2+2H2O=SO42-+2I-+4H+��
��HI�ֽ�Ϊ���淴Ӧ����ʱ���������H2�������ڷ�Ӧ������У������ɸ����I2����ѭ��ʹ�ã��ʴ�Ϊ��HI�ֽ�Ϊ���淴Ӧ����ʱ���������H2�������ڷ�Ӧ������У������ɸ����I2����ѭ��ʹ�á�

 ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�����Ŀ���������ʵķ������ȫ����ȷ���ǣ� ��
���� | ǿ����� | ������� | �ǵ���� |
A | NaCl | H2O | Cl2 |
B | H2SO4 | CaCO3 | CCl4 |
C | AgCl | HClO | Cu |
D | Ba(OH)2 | H2S | C2H5OH |
A. A B. B C. C D. D