题目内容
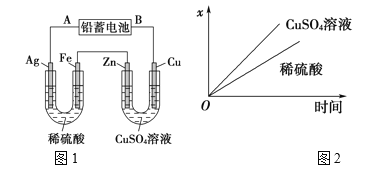
【题目】I.某研究小组探究SO2和Fe(NO3)3溶液的反应。
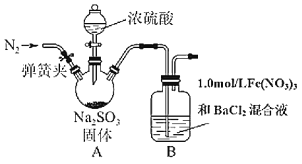
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
(1)用于加入浓硫酸的仪器名称为 ________。装置A中发生的化学方程式为______。
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是_____________。
(3)实验中,装置B中产生了白色沉淀,该沉淀的成分是_______,说明SO2具有______性。
(4)分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
基于观点1,装置B中反应的离子方程式___________。
为证明该观点,应进一步检验生成的新物质,其实验操作及现象为(假定在反应中SO2的量不足_________。
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是 _________ (填序号)。
A.0.1 mol·L-1的稀硝酸 B. 1.5 mol·L-1的Fe(NO3)3溶液
C.6.0 mol·L-1的NaNO3和0.2 mol·L-1盐酸等体积混合的混合液
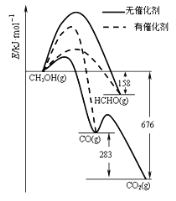
Ⅱ.人们常用催化剂来选择反应进行的方向。 图所示为一定条件下1 mol CH3OH与O2发生反应时生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成_____(填“CO” 、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
【答案】分液漏斗 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 排净装置中的空气,为排除氧气对实验的干扰 BaSO4 还原性 SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+ 取少量B中溶液于试管中,加入少量[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点1合理 C HCHO -470kJ/mol
【解析】
(1)加入浓硫酸的仪器为分液漏斗;A中为亚硫酸钠和硫酸反应生成硫酸钠、二氧化碳和水,方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)氧气和硝酸根离子都能将二氧化硫氧化,如果装置中含有氧气,会干扰实验,所以通入氮气的目的是排净装置中的空气,为排除氧气对实验的干扰;
(3)二氧化硫具有还原性,在酸性条件下,能被硝酸根离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀。
(4)观点1是指二氧化硫和铁离子发生氧化还原反应生成硫酸根离子和亚铁离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,离子方程式为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;为证明该观点,应进一步检验生成的新物质,即亚铁离子,所以操作为:取少量B中溶液于试管中,加入少量[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点1合理;在酸性条件下,二氧化硫和硝酸根离子发生氧化还原反应,只要溶液中的硝酸根离子浓度不变即可,所以选C;
Ⅱ.(1)从图分析,虚线为有催化剂条件下,反应生成HCHO;从图分析,1mol甲醛转化为一氧化碳,反应热为(158-676+283)kJ/mol=-235 kJ/mol,所以热化学方程式为2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=-470kJ/mol。

【题目】实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
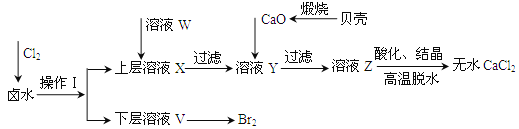
(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是_____。
(2)加入溶液W的目的是______,用CaO调节溶液Y的pH,可以除去Mg2+,由表中数据可知,理论上可选择的pH最大范围是______,酸化溶液Z时,使用的试剂为______。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8molL-1 |