题目内容
6.铁、锰、锌、铜、硼等是农作物生长必需的微量元素.某课题组研究利用废弃锌锰电池和工业废料硼镁泥生产复合微量元素肥料〔简称复合微肥).流程如下所示: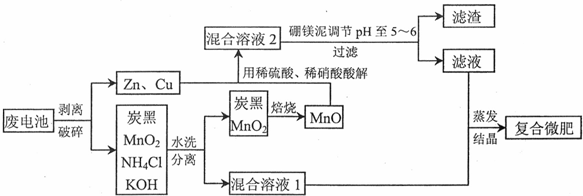
己知:
①硼镁泥中含MgO,Na2B407,MnO,Fe203,Si02,CaO等化合物
②Mn02不溶于硫酸和硝酸,MnO可溶于酸
回答下列问题:
(1)上述方法生产的复合微肥除了含有农作物生长必需的多种微量元素外,还含有必需的大量元素氮和钾(填元素名称).
(2)焙烧时反应的化学方程式为MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$MnO+CO↑,焙烧的目的是将不溶于酸的MnO2转化为可溶于酸的MnO
(3)酸解过程中气体产物可循环利用的是NO;酸解后的溶液加入硼镁泥调节溶液pH时,有H3B03沉淀生成,该反应的离子方程式为B4O72-+2H++5H2O=4H3BO3↓;已知:25℃,Ksp[Mn(OH)2]=1.9×10-13<Ksp[Mg(OH)2],若溶液的pH调节到6,计算说明是否会析出Mn(OH)2,Mg(OH)2沉淀PH=6,c(OH-)=10-8mol/L,若析出Mn(OH)2沉淀,所需c(Mn2+)的最小值为$\frac{1.9×1{0}^{-13}}{(1×1{0}^{-8})^{2}}$=1900mol/L,c(Mn2+)不可能达到此数值,故不能析出Mn(OH)2沉淀,由于Ksp(Mn(OH)2)<Ksp(Mg(OH)2),所以Mn(OH)2也不可能析出.
(4)产品中锰元素含量的测定:称取ag产品,溶于适量蒸馏水中,向所得溶液中加入足量NaClO溶液,发生反应Mn2++ClO-+H2O═MnO2↓+2H++Cl-,过滤、洗涤、干燥后称得Mn02质量为b g,则产品中锰元素的质量分数为$\frac{55b}{87a}$×100%.
(5)己知玻璃可微量溶于水.实际生产中,常选用废玻璃、粉煤灰、炼钢炉渣和矿石等为原料高温烧制,将熔融物冷水淬冷成块,再磨成细粉即得玻璃微肥.玻璃微肥具有的优点是.肥分缓释,肥分时间长或不易被雨水淋失或不污染环境(任答一条即可).
分析 废电池剥离破碎分离为锌、铜金属和炭黑、MnO2、NH4Cl、KOH,其中炭黑、MnO2、NH4Cl、KOH水洗过滤得到滤渣炭黑、MnO2,滤液混合溶液Ⅰ为NH4Cl、KOH水溶液反应后得到一水合氨和氯化钾,Zn、Cu、MnO被稀硫酸和稀硝酸溶解得到混合溶液Ⅱ,Mn02不溶于硫酸和硝酸,MnO可溶于酸,所以溶液中含有Zn2+、Cu2+、Mn2+,加入硼镁泥中含MgO,Na2B407,MnO,Fe203,Si02,CaO等化合物来调节溶液PH=5-6,有H3B03沉淀生成,过滤得到滤液和混合溶液Ⅰ混合,通过蒸发浓缩,冷却结晶,过滤洗涤得到复合微肥;
(1)复合微肥的成分为滤液混合溶液Ⅰ为NH4Cl、KOH水溶液反应后得到一水合氨和氯化钾,和滤液混合含有农作物生长必需的多种微量元素外,还含有必需的大量元素氮和钾元素;
(2)焙烧时反应为二氧化锰和碳发生氧化还原反应,生成MnO可溶于酸;
(3)酸解过程中是锌、铜在稀硝酸溶液中被氧化,稀硝酸被还原为NO,一氧化氮和空气混合溶于水可以重新生成稀硝酸,酸解后的溶液加入硼镁泥调节溶液pH时,有H3B03沉淀生成,是Na2B407和酸反应生成;PH=6,c(OH-)=10-8mol/L,依据溶度积常数计算沉淀所需要的锰离子浓度分析判断,氢氧化镁和氢氧化锰阴离子和阳离子组成比相同,可以利用溶度积常数大小比较溶解度大小;
(4)依据锰元素守恒,结合离子方程式定量关系计算得到;
(5)选用废玻璃、粉煤灰、炼钢炉渣和矿石等为原料高温烧制,将熔融物冷水淬冷成块,再磨成细粉即得玻璃微肥,减少溶解避免流失.
解答 解:废电池剥离破碎分离为锌、铜金属和炭黑、MnO2、NH4Cl、KOH,其中炭黑、MnO2、NH4Cl、KOH水洗过滤得到滤渣炭黑、MnO2,滤液混合溶液Ⅰ为NH4Cl、KOH水溶液反应后得到一水合氨和氯化钾,Zn、Cu、MnO被稀硫酸和稀硝酸溶解得到混合溶液Ⅱ,Mn02不溶于硫酸和硝酸,MnO可溶于酸,所以溶液中含有Zn2+、Cu2+、Mn2+,加入硼镁泥中含MgO,Na2B407,MnO,Fe203,Si02,CaO等化合物来调节溶液PH=5-6,有H3B03沉淀生成,过滤得到滤液和混合溶液Ⅰ混合,通过蒸发浓缩,冷却结晶,过滤洗涤得到复合微肥;
(1)复合微肥的成分为滤液混合溶液Ⅰ为NH4Cl、KOH水溶液反应后得到一水合氨和氯化钾,和滤液混合含有农作物生长必需的多种微量元素外,还含有必需的大量元素氮和钾元素;
故答案为:钾;
(2)Mn02不溶于硫酸和硝酸,焙烧时反应为二氧化锰和碳发生氧化还原反应,生成MnO可溶于酸,反应的化学方程式为:MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$MnO+CO↑,焙烧目的是将不溶于酸的MnO2转化为可溶于酸的MnO,
故答案为:MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$MnO+CO↑;将不溶于酸的MnO2转化为可溶于酸的MnO;
(3)酸解过程中是锌、铜在稀硝酸溶液中被氧化,稀硝酸被还原为NO,一氧化氮和空气混合溶于水可以重新生成稀硝酸,可循环利用,酸解后的溶液加入硼镁泥调节溶液pH时,有H3B03沉淀生成,是Na2B407和酸反应生成,反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3↓,PH=6,c(OH-)=10-8mol/L,依据溶度积常数计算沉淀所需要的锰离子浓度,若析出Mn(OH)2沉淀,所需c(Mn2+)的最小值为$\frac{1.9×1{0}^{-13}}{(1×1{0}^{-8})^{2}}$=1900mol/L,c(Mn2+)不可能达到此数值,故不能析出Mn(OH)2沉淀,氢氧化镁和氢氧化锰阴离子和阳离子组成比相同,可以利用溶度积常数大小比较溶解度大小,由于Ksp(Mn(OH)2)<Ksp(Mg(OH)2),所以Mn(OH)2也不可能析出,
故答案为:NO;B4O72-+2H++5H2O=4H3BO3↓;PH=6,c(OH-)=10-8mol/L,若析出Mn(OH)2沉淀,所需c(Mn2+)的最小值为$\frac{1.9×1{0}^{-13}}{(1×1{0}^{-8})^{2}}$=1900mol/L,c(Mn2+)不可能达到此数值,故不能析出Mn(OH)2沉淀,由于Ksp(Mn(OH)2)<Ksp(Mg(OH)2),所以Mn(OH)2也不可能析出;
(4)依据锰元素守恒,结合离子方程式定量关系计算,发生反应Mn2++ClO-+H2O═MnO2↓+2H++Cl-,n(MnO2)=n(Mn)=$\frac{bg}{87g/mol}$=$\frac{b}{87}$mol,则产品中锰元素的质量分数=$\frac{\frac{b}{87}mol×55g/mol}{ag}$×100%=$\frac{55b}{87a}$×100%,
故答案为:$\frac{55b}{87a}$×100%;
(5)玻璃可微量溶于水,选用废玻璃、粉煤灰、炼钢炉渣和矿石等为原料高温烧制,将熔融物冷水淬冷成块,再磨成细粉即得玻璃微肥,减少溶解避免流失,玻璃微肥具有的优点是肥分缓释,肥分时间长或不易被雨水淋失或不污染环境,
故答案为:肥分缓释,肥分时间长或不易被雨水淋失或不污染环境.
点评 本题考查了物质分离和提纯的分析判断,主要是反应条件,物质性质的理解应用,沉淀溶解平衡,溶度积常数的计算应用,掌握基础是关键,题目难度中等.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案| A. | Na2CO3的稳定性介于Na2CO3•10H2O和NaHCO3之间 | |
| B. | “侯氏制碱法”制得的碱是指NaHCO3 | |
| C. | 可用盐酸鉴别Na2CO3 和NaHCO3固体 | |
| D. | 纯碱有时可代替烧碱使用,比如溶解石英、吸收氯气等 |
| A. | 所得溶液中c(Ag+)•c(Cl-)>Ksp(AgCl) | |
| B. | 上述实验说明Cl-与NH4+间有很强的结合力 | |
| C. | 所得溶液中形成了难电离的物质 | |
| D. | 上述过程中NH3•H2O的电离常数增大 |
①“构造原理”是所有原子随原子序数递增,核外电子排布遵循的规律
②4s轨道的能量一定比3d轨道的能量低
③同一电子层中三个p轨道的能量一定相等
④原子核外电子排布遵循“使整个原子处于能量最低的状态”为总原则.
| A. | ①② | B. | ②③④ | C. | ②④ | D. | ①③ |
| A. | 铍的氧化物对应的水化物可能具有两性 | |
| B. | 砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 | |
| C. | 高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性弱 | |
| D. | 硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
| A. | 乙烯 | B. | 乙炔 | C. | 丙烯 | D. | 丙炔 |
①霓虹灯发出有色光;
②棱镜分光;
③激光器产生激光;
④石油蒸馏;
⑤凸透镜聚光;
⑥燃放的焰火,在夜空中呈现五彩缤纷;
⑦日光灯通电发光;
⑧冷却结晶;
⑨焰色反应.
| A. | ②④⑤⑧⑨ | B. | ①③⑥⑦⑨ | C. | ①③⑤⑥⑦ | D. | ①②③⑤⑥⑦ |
 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )| A. | 电解时惰性电极应与直流电源的负极相连 | |
| B. | 通电后阴极室产生的现象为:产生无色气体,溶液由无色变黄色 | |
| C. | 制备过程中总的离子方程式为:2CrO42-+3H2O=Cr2O72-+2OH-+2H2↑+O2↑ | |
| D. | 若实验开始时在右室中加入38.8克的K2CrO4,tmin后测得右室中K与Cr的物质的量之比为3:2,此时电路中转移电子的物质的量为0.1mol |
 卤素的单质及其化合物在生产、生活中应用广泛.
卤素的单质及其化合物在生产、生活中应用广泛. (如${\;}_{1}^{2}$H).
(如${\;}_{1}^{2}$H).