题目内容
11.运用元素周期律分析下面的推断,其中错误的是( )| A. | 铍的氧化物对应的水化物可能具有两性 | |
| B. | 砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 | |
| C. | 高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性弱 | |
| D. | 硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
分析 A、元素周期表中的对角线规则:处于对角线的元素具有相似性;
B、同主族元素性质具有相似性;
C、同周期从左到右元素的最高价氧化物的水化物的酸性增强;
D、同主族元素及其化合物的性质具有相似性.
解答 解:A、元素周期表中Be和Al处于对角线位置上,处于对角线的元素具有相似性,Be、BeO、Be(OH)2均有两性,故A正确;
B、卤族元素性质具有相似性,根据碘的性质、碘化物的性质、银盐的性质可推知砹(At)为有色固体;HAt不稳定;AgAt是不溶于水的有色固体,故B正确;
C、同周期从左到右元素的最高价氧化物的水化物的酸性增强,则高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性强,故C错误;
D、锶与钡是同主族元素,BaSO4是难溶于水和盐酸的白色固体,所以SrSO4也是难溶于水和盐酸的白色固体,故D正确.
故选C.
点评 本题考查同主族元素的性质的相似性和递变性,侧重于学生的分析能力的考查,题目难度不大,注意把握元素周期律的递变性和相似性.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
7.某同学通过下列实验探究Mg及其化合物的性质,操作正确且能达到目的是( )
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 镁必须密封保存在容器中,防止镁跟空气中的氧气反应 |
2.下列变化中,元素价态变化与反应:3NO2+H2O═2HNO3+NO属于同一类型的是( )
| A. | 2FeCl3+H2S═2FeCl2+2HCl+S↓ | |
| B. | 2NH4Cl+6HCl+K2Cr2O7═2KCl+N2↑+2CrCl3+7H2O | |
| C. | 3Br2+6NaOH═NaBrO3+5NaBr+3H2O | |
| D. | 5H2S+2KMnO4+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
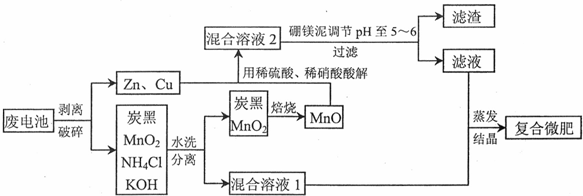
19.为研究SO2气体的性质,某小组设计完成如图实验.
(Ⅰ)将适量纯的SO2气体通入到下列溶液中产生现象如下:
(1)实验②中通入一段时间后才渐渐产生黄色沉淀,表现SO2的氧化性和水溶液酸性;实验⑤中反应的离子方程式为2S2-+5SO2+2H2O=3S↓+4HSO3-;
(Ⅱ)某小组探究铜与浓硫酸反应的产物.将铜与浓硫酸在烧瓶中共热时,液面上产生大量白雾,铜表面先变黑后渐渐溶解;产生的气体依次通过品红溶液和BaCl2溶液,品红溶液褪色,却意外发现BaCl2溶液也能产生白色沉淀;反应所得灰绿色溶液下沉积少量白色固体,倾倒出液体后的白色固体小心加水,溶解后溶液呈蓝色.
【查阅资料】:①Cu2S不溶于稀硫酸,能够溶于热的稀硝酸中,且产生SO42-离子.
②98.3%浓硫酸的沸点:339℃;纯硫酸温度高于500℃部分分解;
(2)对产生的气体通入使BaCl2溶液产生沉淀原因做出猜想并设计实验加以验证.
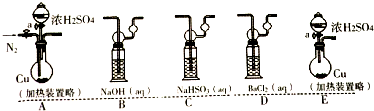
(a)若考虑装置中的空气中某成分作用于SO2使之产生沉淀,为消除这一因素,装置的选择与连接顺序为CAD;(选给定3个装置,见如图)
(b)利用所设计的装置进行实验依然发现BaCl2溶液产生沉淀,则可能的原因是浓硫酸分解生成二氧化硫和氧气,则排除此因素,装置选择和连接顺序为ACD;(给定装置,如图)
(3)探究上述实验过程中铜表面产生的黑色固体组成,某同学猜想可能为CuO或Cu2S的一种,将不溶解的表面有黑色物质附着的铜滤出、清洗、干燥、磨碎.
下列实验设计能够确认上述同学猜想的是( )
A、取少量样品加入稀硝酸加热观察是否溶解,试管口是否有气体变浅棕色;
B、取少量样品加入稀硫酸充分振荡,观察溶液是否变蓝色;
C、取少量样品加入足量稀硝酸加热溶解,加入BaCl2检验SO42-离子是否产生.
(4)取上述反应的烧瓶中残留物制备CuSO4•5H2O晶体,残留物去除不溶物后中缓缓加入适量水,溶解、蒸发浓缩、冷却结晶、过滤洗涤、干燥称重得该晶体.

(Ⅰ)将适量纯的SO2气体通入到下列溶液中产生现象如下:
| 溶液 | ①品红溶液 | ②Na2S | ③BaCl2 | ④Ba(OH)2 | ⑤Ba(NO3)2 |
| 现象 | 溶液褪色 | 黄色沉淀 | 无明显现象 | 白色沉淀 | 白色沉淀 |
(Ⅱ)某小组探究铜与浓硫酸反应的产物.将铜与浓硫酸在烧瓶中共热时,液面上产生大量白雾,铜表面先变黑后渐渐溶解;产生的气体依次通过品红溶液和BaCl2溶液,品红溶液褪色,却意外发现BaCl2溶液也能产生白色沉淀;反应所得灰绿色溶液下沉积少量白色固体,倾倒出液体后的白色固体小心加水,溶解后溶液呈蓝色.
【查阅资料】:①Cu2S不溶于稀硫酸,能够溶于热的稀硝酸中,且产生SO42-离子.
②98.3%浓硫酸的沸点:339℃;纯硫酸温度高于500℃部分分解;
(2)对产生的气体通入使BaCl2溶液产生沉淀原因做出猜想并设计实验加以验证.
(a)若考虑装置中的空气中某成分作用于SO2使之产生沉淀,为消除这一因素,装置的选择与连接顺序为CAD;(选给定3个装置,见如图)
(b)利用所设计的装置进行实验依然发现BaCl2溶液产生沉淀,则可能的原因是浓硫酸分解生成二氧化硫和氧气,则排除此因素,装置选择和连接顺序为ACD;(给定装置,如图)
(3)探究上述实验过程中铜表面产生的黑色固体组成,某同学猜想可能为CuO或Cu2S的一种,将不溶解的表面有黑色物质附着的铜滤出、清洗、干燥、磨碎.
下列实验设计能够确认上述同学猜想的是( )
A、取少量样品加入稀硝酸加热观察是否溶解,试管口是否有气体变浅棕色;
B、取少量样品加入稀硫酸充分振荡,观察溶液是否变蓝色;
C、取少量样品加入足量稀硝酸加热溶解,加入BaCl2检验SO42-离子是否产生.
(4)取上述反应的烧瓶中残留物制备CuSO4•5H2O晶体,残留物去除不溶物后中缓缓加入适量水,溶解、蒸发浓缩、冷却结晶、过滤洗涤、干燥称重得该晶体.
16.关于金属冶炼的叙述正确的是( )
| A. | 工业上可利用铝热反应大量冶炼金属铁 | |
| B. | 金属钠、铝和铜都可用还原法制备 | |
| C. | 电解饱和氯化镁溶液可得金属镁 | |
| D. | 用足量CO还原磁铁矿得到9 mol铁时转移24 mol电子 |
3.下列化学方程式中,不能用离子方程式H++OH-=H2O表示的是( )
| A. | 2NaOH+H2SO4=NaSO4+2H2O | B. | Ba(OH)2+2 HCl=BaCl2+2H2O | ||
| C. | Ba(OH)2+H2SO4=BaSO4↓+2H2O | D. | Na2CO3+H2SO4=Na2SO4+2H2O+CO2↑ |
20.欲除去甲烷中混有的少量乙烯气体,可以通过装有下列哪种试剂的洗气瓶( )
| A. | 氢氧化钠溶液 | B. | 极稀的溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 水 |
1.下列A、B两种元素的原子序数,其中可以组成AB2型共价化合物的是( )
| A. | 19和16 | B. | 6和8 | C. | 12和8 | D. | 10和2 |