题目内容
【题目】某同学用铁、铜作为电极,稀硫酸作为电解液组成原电池,如图所示,完成下列空格。
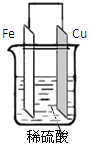
(1)正极是 (填“铜极”或“铁极”),现象是: ,电极反应是: ,发生 反应(填“氧化”或“还原”)。
(2)电流从 经导线流到 (填“铜极”或“铁极”)。
(3)若反应生成的氢气在标况下为4.48L,则反应过程中有 mol电子发生转移,溶解的铁质量为_____________g。
【答案】
(1)铜极,产生气体,H++e-=H2 还原。
(2)铜极;铁极
(3)0.4mo'l,1.12g
【解析】
试题分析:(1)铁的活泼性大于铜,所以铜是正极;正极上氢离子得电子生成氢气,所以看到的现象是有气泡生成,发生还原反应,故答案为:铜极;有气泡产生;2H++2e-=H2↑;还原;
(2)电子的流向是从负极沿导线到正极,电流的方向与电子的流向相反,故答案为:铜极;铁极;
(3)Fe+H2SO4 =F eSO4 +H2↑ 转移电子
56g 22.4L 2mol
11.2g 4.48L 0.4mol
故答案为:0.4;11.2。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目