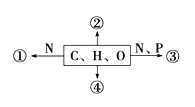
题目内容
【题目】汽车内燃机工作时产生的电火花和高温会引起反应:N2(g)+O2(g)═2NO(g),导致汽车尾气中的NO和NO2对大气造成污染.
(1)在不同温度(T1 , T2)下,一定量的NO分解产生N2和O2的过程中N2的体积分数随时间t变化如图1所示.根据图像判断反应N2(g)+O2(g)═2NO(g)为反应(填“吸热”或“放热”),随着温度的升高,该反应的平衡常数K(填“增大”“减小”或“不变”,平衡向移动(填“向左”“向右”或“不”). 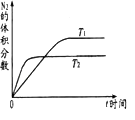
(2)某温度时,向容积为1L的密闭容器中充入5mol N2与2.5mol O2 , 发生N2(g)+O2(g)═2NO(g)反应,2min后达到平衡状态,NO的物质的量为1mol,则2min内氧气的平均反应速率为 , 该温度下,反应的平衡常数K= . 该温度下,若开始时向上述容器中加入的N2与O2均为1mol,则N2的平衡浓度为mol/L.
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.写出上述变化中的总化学反应方程式: . 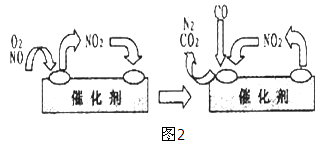
(4)用CH4催化还原NO2的方法也可以消除氮氧化物的污染.例如: CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ/mol
写出CH4还原NO2至N2的热化学方程式 .
【答案】
(1)吸热;增大;向右
(2)0.25mol/(L?min);![]() ;
;![]()
(3)2NO+O2+4CO ![]() CO2+N2
CO2+N2
(4)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
【解析】解:(1)根据图2判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应; 升高温度平衡向正反应移动,故平衡常数K值增大,
所以答案是:吸热,增大,向右;(2)利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量.
N2(g)+ | N2(g)+ | 2NO(g) | ||
起始(mol): | 5 | 2.5 | 0 | |
反应(mol): | 0.5 | 0.5 | 1 | |
平衡(mol): | 4.5 | 2 | 1 |
故v(O2)= ![]() =0.25mol/(Lmin);
=0.25mol/(Lmin);
所以平衡常数k= ![]() =
= ![]() =
= ![]() ;
;
令N2转化的物质的量为xmol,则
N2(g)+ | N2(g)+ | 2NO(g) | ||
起始(mol): | 1 | 1 | 0 | |
反应(mol): | x | x | 2 x | |
平衡(mol): | 4.51﹣x | 1﹣x | 2x |
所以 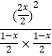 =
= ![]() ,解得x=
,解得x= ![]() ,
,
故N2的平衡浓度为1﹣ ![]() =
= ![]() mol/L,
mol/L,
所以答案是:0.25mol/(Lmin), ![]() ,
, ![]() ;(3)NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2 , 反应方程式为:2NO+O2+4CO
;(3)NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2 , 反应方程式为:2NO+O2+4CO ![]() CO2+N2 , 所以答案是:2NO+O2+4CO
CO2+N2 , 所以答案是:2NO+O2+4CO ![]() CO2+N2;(4)CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ/mol①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ/mol②,由
CO2+N2;(4)CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ/mol①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ/mol②,由 ![]() (①+②)得到:反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=
(①+②)得到:反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H= ![]() ×[(﹣574)+(﹣1160)]=﹣867kJmol﹣1 , 所以答案是:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol.
×[(﹣574)+(﹣1160)]=﹣867kJmol﹣1 , 所以答案是:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol.
【考点精析】本题主要考查了反应速率的定量表示方法和化学平衡状态本质及特征的相关知识点,需要掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】控制“酸雨”是防治大气污染的重要问题之一。煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用Ca(ClO)2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)Ca(ClO)2中氯元素的化合价为___________。
(2)工业上制备Ca(ClO)2的化学方程式_________________________________________________。
(3)实验室在鼓泡反应器中通入含有SO2的烟气,反应温度为323 K,Ca(ClO)2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | Cl |
c/(mol·L1) | 5×103 | 1×102 |
写出Ca(ClO)2溶液在脱硫过程中主要反应的离子方程式____________________________________。
(4)目前可用电化学方法处理由二氧化硫引起的酸雨。常见的一种方法是惰性电极电解氢溴酸,其阳极的电极反应为:___________________________________。阴极的电极反应为:_________________________________。总反应的化学方程式为:___________________________。
(5)将其阳极产物用水溶解配成溶液去淋洗含二氧化硫的废气。上述吸收废气发生的反应化学方程式为:________________________________________。若反应中转移电子1mol,则可吸收二氧化硫气体体积在标准状况下为_________L。