题目内容
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线:
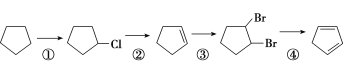
(1)反应①的产物名称是________,反应的化学方程式为___________________。
(2)反应②的反应试剂和反应条件是________,反应③的反应类型是________。
(3)![]() 与NaOH水溶液反应的化学方程式________________________。
与NaOH水溶液反应的化学方程式________________________。
【答案】氯代环戊烷 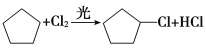 NaOH的乙醇溶液,加热 加成反应
NaOH的乙醇溶液,加热 加成反应 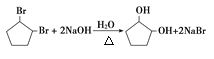
【解析】
反应①为取代反应,反应②为卤代烃在氢氧化钠醇溶液、加热条件下发生消去反应,反应③为环戊烯与溴发生的加成反应,反应④为卤代烃在氢氧化钠醇溶液、加热条件下发生消去反应,据此分析;
反应①为取代反应生成一氯环戊烷,反应②为一氯环戊烷在氢氧化钠醇溶液、加热条件下发生消去反应生成环己烯,反应③为环戊烯与溴发生的加成反应生成1,2二溴环戊烷,反应④为1,2二溴环戊烷在氢氧化钠醇溶液、加热条件下发生消去反应生成1,3环戊二烯,
则(1)反应①的产物为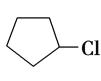 ,其名称为:氯代环戊烷,主要是由环戊烷与氯气在光照条件下发生取代反应所得,其方程式为:
,其名称为:氯代环戊烷,主要是由环戊烷与氯气在光照条件下发生取代反应所得,其方程式为: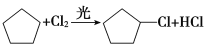 ,
,
故答案为:氯代环戊烷; ;
;
(2)反应②为卤代烃的消去反应,其反应条件为:氢氧化钠的乙醇溶液,加热;反应③为碳碳双键的加成反应,
故答案为:NaOH的乙醇溶液,加热;加成反应;
(3)氯代烃与氢氧化钠水溶液作用会发生取代反应,生成相应的醇,则![]() 与NaOH水溶液在加热条件下反应的化学方程式为:
与NaOH水溶液在加热条件下反应的化学方程式为: ,
,
故答案为: 。
。

【题目】下表是元素周期表的一部分,请回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ⑩ | ② | |||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
四 | ⑧ | ⑨ |
(1)在这些元素中,最活泼的非金属元素是___(元素符号),原子最外层达到稳定结构的元素是__(元素符号);
(2)元素的最高价氧化物对应的水化物中酸性最强的是____(填化学式);
(3)写出④的氧化物与③的最高价氧化物对应的水化物相互反应的化学方程式_____;
(4)③、⑥、⑧的原子半径由大到小为__﹥___﹥__/span>(填元素符号)①、⑤的最高价含氧酸酸性__﹥__(均填化学式);
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式________;
(6)写出实验室制备⑩的氢化物的化学方程式_________。
【题目】农业对化肥的需求是合成氨工业发展的持久推动力。在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
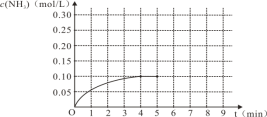
(1)N2(g)+3H2(g)![]() 2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图像,计算从反应开始到平衡时,氮气的平均反应速率为___________________。
2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图像,计算从反应开始到平衡时,氮气的平均反应速率为___________________。
(2)该温度下,反应N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式为__________。
2NH3(g)+ Q(Q>0)的平衡常数表达式为__________。
其平衡常数K与温度T的关系如下表:
T/℃ | 25 | 125 | 225 |
平衡常数K | 4×106 | K1 | K2 |
试判断K1______ K2(填写“>”“=”或“<”)。原因是_________________________________
(3)下列能说明合成氨反应已达到平衡状态的是________(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2) b. ![]() 不发生变化 c.混合气体的密度保持不变
不发生变化 c.混合气体的密度保持不变
d.25℃时,测得容器中 c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
(4) 催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式并标出电子转移的方向和数目:____________;该反应中氧化产物与还原产物的物质的量之比为____。
(5) pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”)
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为____g,假设广口瓶里生成一种正盐,其质量为______g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)该燃料中碳、氢元素质量比为________.
【题目】肼(N2H4)是一种应用广泛的化工原料。工业上先合成氨气:N2(g)+3H2(g) ![]() 2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:
2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:

(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同),则生产中适宜选择的催化剂是___(填“A”或“B”或“C”),理由是:________________。
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)
反应速率 | 平衡常数K | 氨的体积分数 | |
变化情况 | __ | ____ | ____ |
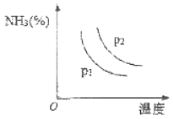
(3)肼可作为火箭燃料,4gN2H4(g)在NO2气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:________。
(4)氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,己知初始时n(N2):n(H2)=1:3。判断pl、p2压强的大小关系,pl___p2(选填“>”、“<”或“=”)。