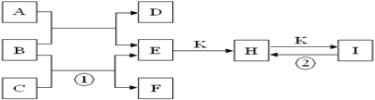
题目内容
【题目】将1gH2和4gO2混合点燃,充分反应,放出71.45kJ热量,同样条件下2molH2在O2中完全燃烧放出的热量是( )
A.71.45kJB.142.9kJC.571.6kJD.285.8KJ
【答案】C
【解析】
1g H2 的物质的量为![]() = 0.5mol ,
= 0.5mol ,
4g O2的物质的量为![]() = 0.125mol,
= 0.125mol,
反应2H2+O 2= 2H2O,由方程式可以知道,0.125mol氧气完全反应需要消耗氢气为0.125mol×2 = 0.25mol ,小于0.5mol ,故氢气过量,所以放出71.45kJ热量时参加反应的氢气的物质的量为0.25mol ,同样条件下2mol H2 在O2中完全燃烧放出的热量是: 71.45kJ×8= 571.6kJ。
故选C。

练习册系列答案
相关题目