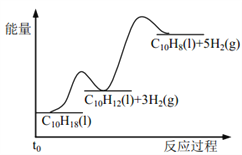
题目内容
【题目】足量铜与一定量浓硝酸反应得到硝酸铜溶液和 NO2、N2O4、NO 的混合气体,这些气体与 4.48 L O2(标准状况)混合后通入水中,气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 400 mL NaOH溶液,此时 Cu2+恰好沉淀完全,所用 NaOH 溶液的浓度是( )
A.2 mol/LB.4 mol/LC.6 mol/LD.0.8 mol/L
【答案】A
【解析】
利用得失电子守恒,可得关系式2Cu—O2—2Cu2+,n(O2)=![]() =0.2mol,则n(Cu2+)=0.4mol,再由关系式Cu2+——2OH-,可求出n(NaOH)= 0.4mol×2=0.8mol,c(NaOH)=
=0.2mol,则n(Cu2+)=0.4mol,再由关系式Cu2+——2OH-,可求出n(NaOH)= 0.4mol×2=0.8mol,c(NaOH)=![]() =2mol/L,故选A。
=2mol/L,故选A。

【题目】硫及其化合物有许多用途,相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态S原子电子占据最高能级的电子云轮廓图为___形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是__。
(3)图(a)为S8的结构,其硫原子的杂化轨道类型为___。
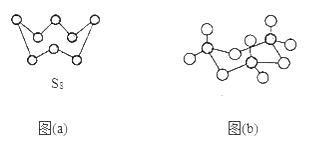
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为___形;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__。
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________,M2+的核外电子排布式为________________________。
(2)写出两个与YZ2互为等电子体的化学式_________________ 。
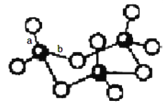
(3)WZ2分子中W原子价层电子对数是_____________对,WZ2的VSEPR 模型名称为_______________,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________;WZ3的三聚体环状结构如图所示,该结构中W原子的杂化轨道类型为__________;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________(填图中字母) ,该分子中含有______个σ键。