��Ŀ����
����Ŀ�����仯������������;��������ʵ��������������ʾ��
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
�۵�/�� | -85.5 | 115.2 | >600(�ֽ�) | -75.5 | 16.8 | 10.3 |
�е�/�� | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
�ش��������⣺
��1����̬Sԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ___�Ρ�
��2�����ݼ۲���ӶԻ������ۣ�H2S��SO2��SO3����̬�����У�����ԭ�Ӽ۲���Ӷ�����ͬ�������ӵ���__��
��3��ͼ(a)ΪS8�Ľṹ������ԭ�ӵ��ӻ��������Ϊ___��
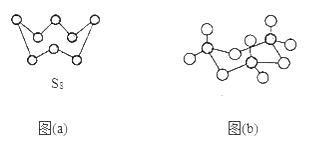
��4����̬���������Ե�������ʽ���ڣ�����ӵ����幹��Ϊ___�Σ��������������д�����ͼ(b)��ʾ�����۷��ӣ��÷�����Sԭ�ӵ��ӻ��������Ϊ__��
���𰸡������� H2S sp3 ƽ���������� sp3
��������
��1����̬Sԭ�ӵ���ռ�ݵ��ܼ���1s��2s��2p��3s��3p������ܼ�Ϊ3p�������������ͼΪ�����Σ�
��2��H2S��Sԭ�Ӽ۲���ӶԸ���=2+![]() =4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+
=4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+![]() =3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+
=3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3��
=3��
��3��ͼ��ʾ��ÿ����ԭ���γ����������ɼ�����Ϊ2����ԭ�Ӻ����������2�Թµ��Ӷԣ�����ԭ�Ӽ۲���Ӷ���=2+2=4��
��4��SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹��Ϊƽ���������Σ��÷�����SOԭ��֮�����������������������Թ��ۼ�����2�֣��÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ����͡�
=3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹��Ϊƽ���������Σ��÷�����SOԭ��֮�����������������������Թ��ۼ�����2�֣��÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ����͡�
��1����̬Sԭ�ӵ���ռ�ݵ��ܼ���1s��2s��2p��3s��3p������ܼ�Ϊ3p�������������ͼΪ�����Σ�
����������
��2��H2S��Sԭ�Ӽ۲���ӶԸ���=2+![]() =4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+
=4��SO2��Sԭ�Ӽ۲���ӶԸ���=2+![]() =3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+
=3��SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3������ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���H2S��
=3������ԭ�Ӽ۲���Ӷ�����ͬ���������ӵ���H2S��
����H2S��
��3����ͼ��ʾ��ÿ����ԭ���γ����������ɼ�����Ϊ2����ԭ�Ӻ����������2�Թµ��Ӷԣ�����ԭ�Ӽ۲���Ӷ���=2+2=4������ԭ�ӵ��ӻ��������Ϊsp3��
����sp3��
��4��SO3��Sԭ�Ӽ۲���ӶԸ���=3+![]() =3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹��Ϊƽ���������Σ��÷�����SOԭ��֮�����������������������Թ��ۼ�����2�֣��÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ�����Ϊsp3��
=3���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���ռ乹��Ϊƽ���������Σ��÷�����SOԭ��֮�����������������������Թ��ۼ�����2�֣��÷�����ÿ��Sԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�Sԭ���ӻ�����Ϊsp3��
��Ϊ��ƽ���������Σ�sp3��

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�����Ŀ��7000Cʱ�����ݻ�Ϊ2L���ܱ������г���һ������CO��H2O��������Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g)����Ӧ�����вⶨ�IJ������ݼ��±�(����t2��t1)
CO2(g)+H2(g)����Ӧ�����вⶨ�IJ������ݼ��±�(����t2��t1)
��Ӧʱ��/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
����˵������ȷ����
A.��Ӧ��t1min�ڵ�ƽ������Ϊ��(CO2)=![]() mol��L-1��min-1
mol��L-1��min-1
B.��t1minʱ����Ӧδ��ƽ��״̬
C.����7000C���䣬��ƽ����ϵ����ͨ��0.60molCO��0.30 molH2O���ﵽ��ƽ��ʱ��ԭƽ����ȣ�COת��������H2�������������
D.�¶�����8000Cʱ��������Ӧ��ƽ�ⳣ��Ϊ0.64��������ӦΪ���ȷ�Ӧ
����Ŀ��ij��ѧС��ͬѧ����ʵ���������Ҵ��Ʊ�1��2-�������顣
��ͬѧ��Ƶ�ʵ��װ������ͼ��
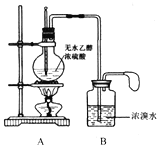
��1����д��A��B�з�������Ҫ��Ӧ�Ļ�ѧ����ʽ
A��________________________________________��
B��________________________________________��
��2����ͬѧ�������ϵ�֪��
�ٴ˷�Ӧ���ܴ��ڵ���Ҫ����Ӧ�У���Ũ����Ĵ����£��Ҵ��ɷ������·�Ӧ�������ѣ� ![]()
�����Ѳ�����ˮ��Ӧ
�й������б����£�
�Ҵ� | 1��2-�������� | ���� | |
��ɫ��״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�е�/�� | 78.5 | 132 | 34.6 |
�����ղ����л����������ѣ�����__________�ķ�����ȥ��
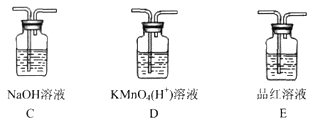
��3����ͬѧ�۲쵽����ʵ�����A��Һ���ڣ���ΪӦ����װ��A��B֮�����װ��__________������ţ�����װ�õ�������____________________��
����Ŀ����ͬ�¶��£����Ϊ2L���������������з�����![]() ��Ϊ��̬����
��Ϊ��̬����![]() ���±���ʾʵ�����ݣ�
���±���ʾʵ�����ݣ�
������� | ��ʼʱ�����ʵ����ʵ��� | �ﵽƽ��ʱ��ϵ�����ı仯 | ||
|
|
| ||
�� | 1 | 3 | 0 |
|
�� | 0 | 0 | 2 |
|
�� |
|
|
|
|
�����й�˵����ȷ����
A.![]()
B.����![]() ��ת���ʴ��ڢ���
��ת���ʴ��ڢ���![]() ��ת����
��ת����
C.��������۷ֱ�ﵽƽ��ʱ��ƽ�ⳣ����ͬ����![]()
D.�������ٵķ�Ӧ������Ϊ���º�ѹ�н���![]() Ͷ��������
Ͷ��������![]() ���ﵽƽ��ʱ������ƽ��Ħ�������Ϻ��º���ʱ��С��
���ﵽƽ��ʱ������ƽ��Ħ�������Ϻ��º���ʱ��С��
����Ŀ��һ���¶��£������������Ϊ![]() �����ܱ������з�����Ӧ��
�����ܱ������з�����Ӧ��
![]()
����˵����ȷ����![]()
���ڱ�� | �¶� | ��ʼ���ʵ��� | ƽ�����ʵ��� | |
|
|
| ||
1 | 380 |
|
|
|
2 | 380 |
| ||
3 | 230 |
|
|
|
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.�ﵽƽ��ʱ������1�е�![]() �������������2�е�С
�������������2�е�С
C.����1�з�Ӧ�ﵽƽ�������ʱ�������3�еij�
D.����ʼʱ���������г���![]()
![]()
![]() ��
��![]()
![]()
![]() ��
��![]()
![]() ����Ӧ���淴Ӧ�������
����Ӧ���淴Ӧ�������

