题目内容
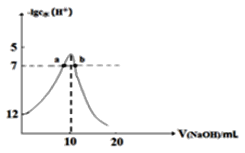
【题目】向10mL一定浓度的HCOOH溶液中不断滴加1mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是( )
A.常温下,Ka(HCOOH)的数量级为10-4
B.a、b两点的pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
【答案】B
【解析】
A.起始时为一定浓度的甲酸溶液,根据图像,当加入的氢氧化钠为10mL时恰好完全反应,说明起始时甲酸溶液的浓度为1mol/L,溶液中c水(H+)=10-12mol/L,水的电离受到抑制,溶液中OH-均是由水的电离出来的,则溶液中c(H+)=![]() =
=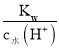 =10-2mol/L,则HCOOH的电离平衡常数为Ka(HCOOH)=
=10-2mol/L,则HCOOH的电离平衡常数为Ka(HCOOH)= =
=![]() ≈10-4,故A正确;
≈10-4,故A正确;
B.酸或碱都会抑制水的电离,而盐类的水解可以促进水的电离,a点由水电离出来的c水(H+)=10-7mol/L,溶液中存在HCOOH和HCOONa,溶液呈中性,b点溶液中组分为HCOONa和过量的NaOH,溶液为碱性,所以a点溶液pH=7,b点溶液pH>7,故B错误;
C.a到b之间存在计量点,计量点时恰好生成HCOONa,此时水的电离程度最大,计量点过后NaOH过量,抑制水的电离,计量点之前HCOONa逐渐增多,HCOOH逐渐减少,水的电离程度增大,所以从a到b的过程,水的电离程度先增大后减小,故C正确;
D.随着NaOH不断加入,溶液中c(OH-)不断增大,溶液中离子浓度不断增大,则溶液导电性不断增强,故D正确;
故选B。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
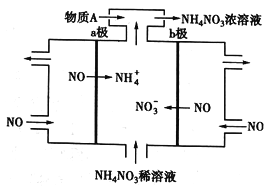
黄冈课堂作业本系列答案【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应