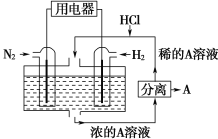
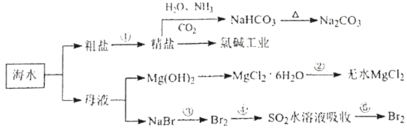
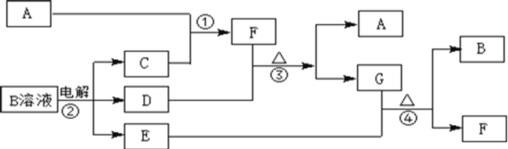
��Ŀ����
����Ŀ����1��ˮ�ȷ��Ʊ�Fe3O4�������ķ�Ӧ��3Fe2++2S2O![]() +O2+4OH-=Fe3O4��+S4O
+O2+4OH-=Fe3O4��+S4O![]() +2H2O��
+2H2O��
�ٲμӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ______��
������2molFe2+����������Fe2+��ԭ��O2�����ʵ���Ϊ______mol��
��ÿ����1molFe3O4����Ӧת�Ƶĵ���Ϊ______mol��
��2������Fe3+��H+��NO![]() �Ļ��Һ�м�������SO
�Ļ��Һ�м�������SO![]() ����Ӧ�����ӷ���ʽΪ______��
����Ӧ�����ӷ���ʽΪ______��
��3����CuSO4��Һ����μ���KI��Һ���������۲쵽�г���(CuI)���ɣ�����Һ��Ϊ��ɫ������Ӧ��Ļ�����в���ͨ��SO2���壬��Һ�����ɫ��д���˹����漰�����ӷ���ʽ______��______��
���𰸡�1:4 0.5 4 2H++2NO![]() +3SO
+3SO![]() =2NO��+ 3SO
=2NO��+ 3SO![]() +H2O 2Cu2++4I- =2CuI��+I2 I2+SO2+2 H2O =2 I-+ SO
+H2O 2Cu2++4I- =2CuI��+I2 I2+SO2+2 H2O =2 I-+ SO![]() +4 H+
+4 H+
��������
����Ԫ�صĻ��ϼ۱仯�����������ͻ�ԭ�������ݵ���ת���غ����������ԭ����ؼ��㣻�������ӵ������Ե�ǿ���ж����Ȳμӷ�Ӧ�����ӣ�����Ԫ�صĻ��ϼ۱仯���ɷ���������ԭ�IJ��ﲢ��ƽ��
(1)ˮ�ȷ��Ʊ�Fe3O4�������ķ�Ӧ��3Fe2++2S2O![]() +O2+4OH-=Fe3O4��+S4O
+O2+4OH-=Fe3O4��+S4O![]() +2H2O��
+2H2O��
�ٸ���Ԫ�صĻ��ϼ۱仯��֪���÷�Ӧ�е���Ԫ��������֮����+2���ߵ�+3����Ԫ��ȫ����+2���ߵ�+2.5�����������е���Ԫ��ȫ����0�۽��͵�-2��O2ֻ����������Fe2+��S2O![]() ������ԭ�������Բμӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ1:4��
������ԭ�������Բμӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ1:4��
��1molO2�ڷ�Ӧ�п��Եõ�4mole-������2molFe2+�������������仯�ϼ۱仯��֪��ʧȥ2mol���ӣ���Fe2+��ԭ��O2�����ʵ���Ϊ0.5mol��
�������Ϸ�����֪��ÿ����1molFe3O4������1molO2�μӷ�Ӧ����Ӧת�Ƶĵ���Ϊ4mol��
(2)����Fe3+��H+��NO![]() �Ļ��Һ�м�������SO
�Ļ��Һ�м�������SO![]() ������������������NO
������������������NO![]() ��������ǿ��Fe3+������ֻ��H+��NO
��������ǿ��Fe3+������ֻ��H+��NO![]() ��SO
��SO![]() ������Ӧ�����ӷ���ʽΪ2H++2NO
������Ӧ�����ӷ���ʽΪ2H++2NO![]() +3SO
+3SO![]() =2NO��+ 3SO
=2NO��+ 3SO![]() +H2O��
+H2O��
(3)��CuSO4��Һ����μ���KI��Һ���������۲쵽�г���(CuI)���ɣ�����Һ��Ϊ��ɫ��˵����I2���ɡ�����Ӧ��Ļ�����в���ͨ��SO2���壬��Һ�����ɫ��˵��I2�ֱ�SO2��ԭΪI-���˹����漰�����ӷ���ʽΪ2Cu2++4I-=2CuI��+I2��I2+SO2+2 H2O =2 I-+ SO![]() +4 H+��
+4 H+��

 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�