题目内容
【题目】二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
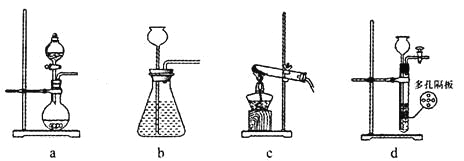
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。
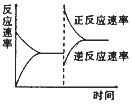
(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
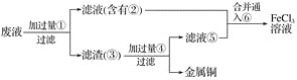
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:
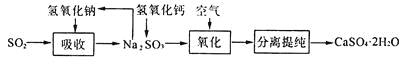
上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为_______________.
【答案】a -196.6 4 < 取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸上,待变色后立即对照标准比色卡读数 2c(SO32-)+c(HSO3-) 减小 Na2SO3+Ca(OH)2![]() CaSO3↓+2NaOH
CaSO3↓+2NaOH
【解析】
(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率;
(2)测得SO2的平衡转化率为50%,可知反应的SO2物质的量为1mol,此过程中放出热量98.3kJ,可知2molSO2参加反应放出的热量,以此计算a值;计算出平衡时各物质的浓度,可计算平衡常数;若将初始温度为T1℃的2mol SO2和1molO2充入容积为2L的绝热密闭容器B中,因正反应放热,则体系温度升高,升高温度平衡逆向移动;
(3)测定pH,可用玻璃棒蘸取溶液,然后与比色卡对比;向A中加入适量的NaOH固体,使溶液恰好呈中性,根据电荷守恒判断离子关系;将溶液B久置于空气中,亚硫酸被氧化生成硫酸,溶液酸性增强;
(4)可循环利用的为NaOH,可用亚硫酸钠与氢氧化钙反应生成。
(1)用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置c;由于亚硫酸钠是细小颗粒,易溶于水,不可选用装置bd,故可选用的发生装置是a;
(2)测得SO2的平衡转化率为50%,可知反应的SO2物质的量为1mol,此过程中放出热量98.3kJ,可知2molSO2参加反应放出的热量为196.6,则a=-196.6;
平衡时:c(SO2)=0.5mol/L,c(O2)=0.5mol/L,c(SO3)=0.25mol/L,K=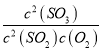 =4;因正反应放热,在绝热密闭容器中进行,体系温度升高,平衡逆向移动,则平衡常数减小;
=4;因正反应放热,在绝热密闭容器中进行,体系温度升高,平衡逆向移动,则平衡常数减小;
(3)测定pH,可用玻璃棒蘸取溶液,然后与比色卡对比,操作方法为取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸上,待变色后立即对照标准比色卡读数;向A中加入适量的NaOH固体,使溶液恰好呈中性,溶液中存在c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(Na+)=2c(SO32-)+c(HSO3-);将溶液B久置于空气中,亚硫酸被氧化生成硫酸,溶液酸性增强,则水的电离程度减小;
(4)可循环利用的为NaOH,可用亚硫酸钠与氢氧化钙反应生成,反应的方程式为Na2SO3+Ca(OH)2=CaSO3↓+2NaOH。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
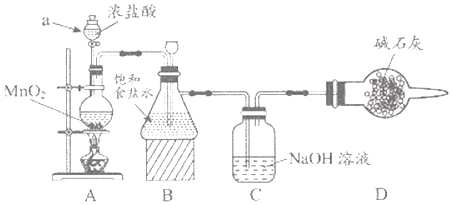
(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:①饱和NaClO溶液pH为11;
②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7.结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为_________。
②盖紧瓶塞并在暗处反应的原因__________滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)