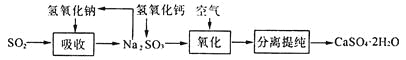
题目内容
【题目】一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
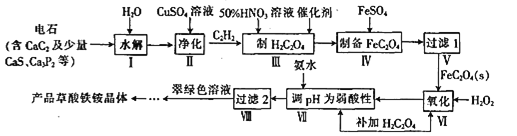
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________,硝酸的浓度及反应温度都不宜过高,是因为____________.
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________.
(6)步骤VIII由滤液制得产品的操作为____________、____________、过滤、洗涤、干燥。
【答案】![]() 4:1
4:1 ![]() 升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化 取最后一次洗涤液少许滴入盐酸酸化的
升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化 取最后一次洗涤液少许滴入盐酸酸化的![]() 溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净 草酸过量,使溶液中
溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净 草酸过量,使溶液中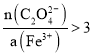 ,从而得到更多的产品 加热(蒸发)浓缩 冷却结晶
,从而得到更多的产品 加热(蒸发)浓缩 冷却结晶
【解析】
(1)CaC2中碳碳共用三对电子,因此可以书写电子式。
(2)根据氧化还原反应化合价升降守恒分析得出。
(3)根据反应信息和氧化还原反应得到化学方程式,由于浓度越大,温度越高,硝酸氧化性越强,易将草酸氧化。
(4)沉淀表面有硫酸根杂质,检验其是否洗涤干净,主要是验证最后一次洗液中是否有硫酸根。
(5)步骤Ⅵ、VII补加草酸,增加草酸浓度,有利于平衡向生成草酸铁铵方向移动得到更多产品。
(6)步骤VIII由滤液制得产品,从溶液到晶体遵循一般采用蒸发浓缩、冷却结晶等。
(1)CaC2的电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,,PH3中P化合价升高8个价态,作还原剂,CuSO4中Cu化合价降低2个,作氧化剂,根据化合价升降守恒,因此该反应中氧化剂与还原剂的物质的量之比为4:1,故答案为:4:1。
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为3C2H2+8HNO3 ![]() H2C2O4+4 H2O+8NO,硝酸具有强氧化性,浓度越大,温度越高,氧化性越强,易将草酸氧化,因此硝酸的浓度及反应温度都不宜过高,是因为升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化,故答案为:3C2H2+8HNO3
H2C2O4+4 H2O+8NO,硝酸具有强氧化性,浓度越大,温度越高,氧化性越强,易将草酸氧化,因此硝酸的浓度及反应温度都不宜过高,是因为升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化,故答案为:3C2H2+8HNO3 ![]() H2C2O4+4 H2O+8NO;升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化。
H2C2O4+4 H2O+8NO;升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化。
(4)“过滤1”需对沉淀进行洗涤,沉淀表面有硫酸根杂质,检验其是否洗涤干净,主要是验证最后一次洗液中是否有硫酸根,其依据是取最后一次洗涤液少许滴入盐酸酸化的BaCl2溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净,故答案为:取最后一次洗涤液少许滴入盐酸酸化的BaCl2溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净。
(5)步骤Ⅵ、VII补加草酸,增加草酸浓度,有利于平衡向生成草酸铁铵方向移动,因此目的是草酸过量,使溶液中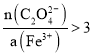 ,从而得到更多的产品,故答案为:草酸过量,使溶液中
,从而得到更多的产品,故答案为:草酸过量,使溶液中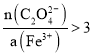 ,从而得到更多的产品。
,从而得到更多的产品。
(6)步骤VIII由滤液制得产品,溶液到晶体一般的操作为加热(蒸发)浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:加热(蒸发)浓缩、冷却结晶。

【题目】雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO![]() 2CO2(g)+N2(g)△H<0
2CO2(g)+N2(g)△H<0
①反应的速率-时间图像如图甲所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图乙所示。以下说法正确的是___________(填对应字母)。
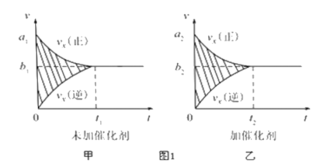
A. a1>a2 B.b1<b2 C.t1>t2 D.图乙中阴影部分面积更大E.图甲中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填代号)

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol
N2O4(g)△H=﹣56.9kJ/mol
H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:______________。
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如表:
温度/℃ | 800 | 1000 | 1200 | 1400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
①该反应是_________反应(填“吸热”或“放热”)。
②T℃时,向1L密闭容器中投入lmolCH4和lmolH2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O![]() CO+3H2的平衡常数K=______________。
CO+3H2的平衡常数K=______________。