题目内容
下列叙述正确的是
| A.FeCl3溶液中加入镁粉有气泡产生 |
| B.C12、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| C.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D.向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
A
解析试题分析:A、FeCl3水解使溶液显酸性,加入镁粉有氢气产生,正确;B、C12使品红溶液褪色,是因为氯气与水反应生成的HClO的氧化性使之褪色,Cl2本身不具有漂白性,B错误;C、铅蓄电池负极为Pb,在放电过程中,负极发生反应Pb-2e-+SO42-=PbSO4,质量增加,C错误;D、CO2溶解度较小,因此向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,无NaHCO3晶体析出,D错误。
考点:考查盐类水解、氯气和二氧化硫的性质、电化学、钠的化合物等知识。

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
下列物质的制取,实验操作正确的是
| A.将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体 |
| B.将NH4HCO3饱和溶液置于蒸发皿中加热蒸于,可制取NH4HCO3固体 |
| C.向FeCl3饱和溶液中缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D.向电石中缓慢滴入饱和食盐水,可制取C2H2 |
向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中
| A.c(Ca2+)、c(OH-)均增大 | B.c(Ca2+)、c(OH-)均保持不变 |
| C.c(Ca2+)、c(OH-)均减小 | D.c(OH-)增大、c(H+)减小 |
下列各项说法中,不正确的是 ( )
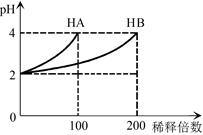
| A.甲是向溴水通入SO2气体时,pH与SO2物质的量的关系图 |
| B.乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C.常温常压下,将2b mol CO2气体通入1L bmol·L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
今有室温下四种溶液,有关叙述正确的是
| | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
B.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
C.①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb= 9∶11
在不同温度下,水溶液中c( )与c(
)与c( )有如图所示关系,下列有关说法正确的是
)有如图所示关系,下列有关说法正确的是
| A.c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B.将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C.t℃>25℃ |
| D.ac线上的任意一点均有pH=7 |
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
| A.pH=1和pH=2的盐酸,c(H+)之比为1:2 |
| B.物质A三态间的转化如下:A(g)→A(1)→A(s),则该转化过程中△S<O |
| C.pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小 |
| D.pH=9的CH3COONa溶液和pH=9的NH3.H2O溶液,两溶液中水的电离程度相同 |
下列说法正确的是
| A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
| B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大 |
| C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变 |
D.若 LpH=11的NaOH溶液与 LpH=11的NaOH溶液与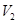 LpH=3的HA溶液混合后显中性,则 LpH=3的HA溶液混合后显中性,则 ≤ ≤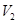 |