题目内容
【题目】随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)下图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
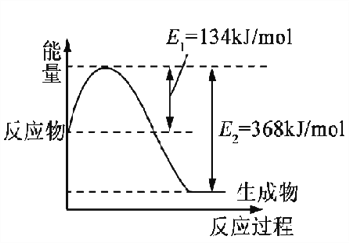
已知:① N2(g)+O2(g)=2NO(g) △H= +179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H= -112.3kJ/mol
请写出NO与CO反应生成无污染气体的热化学方程式: ____________________
(2)将0.20 mol NO2和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如下图所示。
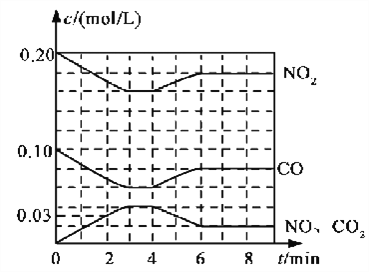
①下列说法正确的是___________(填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)=__________mol·L-1·min-1
③第4 min时改变的反应条件为__________________。
④计算反应在第6 min时的平衡常数K=________。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将________移动(填“正向”、“逆向”或“不”)。
【答案】2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) ΔH=-759.8 kJ/molc0.015升温1/36(或0.028)逆向
N2(g) + 2CO2(g) ΔH=-759.8 kJ/molc0.015升温1/36(或0.028)逆向
【解析】
(1)①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol;②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol;依据图象书写得到热化学方程式③NO2(g)+CO(g)=CO2(g)+NO(g)△H=(134-368)KJ/mol=-234KJ/mol;由盖斯定律②+③-①得到反应的热化学方程式:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=-759.8KJ/mol;
(2)图象分析可知反应为:NO2(g)+CO(g)NO(g)+CO2(g);①a.反应前后气体体积不变,当容器内的压强不发生变化,不能说明该反应达到平衡,故a错误;b.当向容器中加再充入0.20mol NO时,平衡向逆反应方向移动,K值不变,故b错误;c.升高温度后,K值减小,说明平衡逆向进行,NO2的转化率减小,故c正确;d.向该容器内充入He气,总压增大,气体分压不变,所以反应反应速率不变,故d错误;故选c;
②产物NO在0~2min时平均反应速率v(NO)=![]() =0.015mol/Lmin;
=0.015mol/Lmin;
③图象分析可知4min后二氧化氮和一氧化碳浓度增大,一氧化氮和二氧化碳浓度减小,说明平衡逆向进行,反应是放热反应,升温平衡逆向进行,符合图象变化;
④依据图象分析,6min时平衡状态下物质的浓度为c(NO2)=0.18mol/L,c(CO)=0.08mol/L,c(NO)=0.02mol/L,c(CO2)=0.02mol/L,反应的平衡常数依据平衡常数概念计算,NO2(g)+CO(g)![]() NO(g)+CO2(g),K=
NO(g)+CO2(g),K=![]() =
=![]() ;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,浓度商计算Qc=
;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,浓度商计算Qc=![]() =
=![]() >K,平衡逆向进行。
>K,平衡逆向进行。