题目内容
14. 一氧化碳是一种用途十分广泛的化工基础原料.
一氧化碳是一种用途十分广泛的化工基础原料.(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g);△H=-270 kJ•mol-1.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).在不同温度下的化学平衡常数(K)如下表:
| 温度 | 250℃ | 300℃ | 350℃ |
| A | 2.041 | 0.250 | 0.012 |
②在恒容条件下,要提高CO(g)的转化率,可以采取的措施有DE(填字母序号).
A、升高温度 B、加入催化剂 C、增加CO(g)的浓度
D、充入H2(g)加压E、分离出甲醇 F、充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是提高原料利用率.
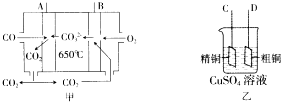
(3)如图甲是--碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请回答下列问题:
①写出A极发生的电极反应式CO-2e-+CO32-=2CO2.
②要进行粗铜的精炼实验时,则B极应与D极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下) CO时,粗铜电极理论上减少铜的质量小于(填“大于”、“等于”或“小于”)6.4g.
分析 (1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
根据盖斯定律,①-②-③得到反应的热化学方程式为2CO(g)+SO2(g)=S(s)+2CO2(g)△H=△H1-△H2-△H3;
(2)①利用三段式法计算出平衡浓度,转化率=$\frac{消耗量}{起始量}$×100%,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,结合平衡常数大小判断反应的温度;
②CO(g)+2H2(g)?CH3OH(g),依据平衡常数随温度变化可知,温度升高,平衡常数减小说明反应是放热反应,在恒容条件下,要提高CO(g)的转化率,可以改变条件使平衡正向进行,注意若只增大CO浓度,平衡向正反应移动,CO的转化率降低;
③合成气进行循环,可以提高原料利用率;
(3)根据CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;根据A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;根据电子得失守恒以及粗铜中除了铜失去电子还有其他金属失去电子;
①根据CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;
②根据A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;
③根据电子得失守恒以及精铜中铜离子得到电子的电极反应来计算,粗铜做阳极含有锌、铁、镍、金、银等,结合电子守恒分析.
解答 解:(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
根据盖斯定律,①-②-③得到反应的热化学方程式为:
2CO(g)+SO2(g)=S(s)+2CO2(g)△H=△H1-△H2-△H3=-270 kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H=-270 kJ•mol-1;
(2)①某温度下,将2molCO(g)和6molH2(g)充入2L的密闭容器中,充分反应后,达到平衡时c(CO)=0.5mol/L,
CO(g)+2H2(g)?CH3OH(g)
起始浓度(mol/L) 1 3 0
转化浓度(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 2 0.5
所以CO的转化率α(CO)=$\frac{0.5mol/L}{1mol/L}$×100%=50%
K=$\frac{c(C{H}_{3}OH)}{c(CO).{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×{2}^{2}}$=0.25,
反应的温度接为300°C;
故答案为:50%;300°C;
②CO(g)+2H2(g)?CH3OH(g),依据平衡常数随温度变化可知,温度升高,平衡常数减小说明反应是放热反应,在恒容条件下,要提高CO(g)的转化率,可以改变条件使平衡正向进行;
A.升高温度,平衡向逆反应移动,平衡时CO的转化率减小,故A错误;
B.加入催化剂,缩短到达平衡时间,平衡不移动,CO转化率不变,故B错误;
C.增加CO的浓度,平衡向正反应移动,平衡时CO的转化率减小,故C错误;
D.加入H2加压,平衡向正反应移动,平衡时CO的转化率增大,故D正确;
E.分离出甲醇,平衡向正反应移动,平衡时CO的转化率增大,故E正确.
F.加入惰性气体加压,反应混合物的浓度不变,变化不移动,故F错误;
故选:DE;
③生产过程中,合成气要进行循环,这样可以提高原料利用率,符合经济效益;
故答案为:提高原料利用率;
(3)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2;
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,
故答案为:D;
③当消耗标准状况下2.24L CO时,电极反应式:CO-2e-+CO32-=2CO2,失去电子为$\frac{2.24L}{22.4L/mol}$×2=0.2mol,精铜电极电极反应式:Cu2++2e-=Cu,由电子得失守恒可知Cu2+的物质的量为0.1mol,精铜电极的质量增加的质量为:0.1mol×64g/mol=6.4g,粗铜做阳极,其中的铜、锌、镍等金属失电子,粗铜电极理论上减少铜的质量一定小于6.4g;
故答案为:小于.
点评 本题考查了学生热化学方程式的书写,化学反应速率化学平衡影响因素分析判断,电解原理的分析应用等有关知识,综合性强,注意粗铜精炼的原理分析,难度中等.

| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N2 |
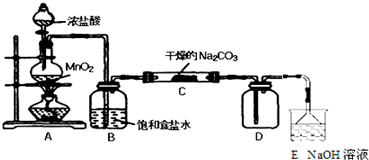
①提出合理猜想:C中一定含有NaHCO3和NaCl;可能含有剩余的Na2CO3.
②设计方案,进行成分检验.请你参与并完成实验步骤3、4以及预期现象和结论,将答案填入下表的相应空格内.限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中, 加入蒸馏水至固体溶解,然后各取1~2mL 所得溶液分别置于甲、乙两支试管中. | 得到无色溶液. |
| 步骤2:向甲试管中加入过量的BaCl2溶液, 静置. | 若溶液变浑浊,证明固体中含有Na2CO3. |
| 步骤3:取甲试管中上层清液少许于另一只 试管中,滴加少量澄清石灰水, 充分振荡. | 若上层清液变浑浊, 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中先加入过量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;证明固体中含有氯化钠. |
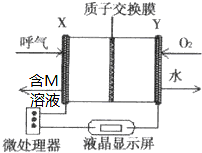 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )| A. | 电池内部H+向X极移动 | |
| B. | 另一极Y极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在X极上发生还原反应,电子经过外电路流向Y极 | |
| D. | 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
| A. | NH${\;}_{4}^{+}$+D2O?NH3•D2O+H+ | B. | NH${\;}_{4}^{+}$+D2O?NH3•HDO+D+ | ||
| C. | c(OD-)•c(H+)=Kw | D. | c(OH-)•c(D+)=Kw |
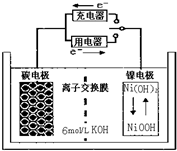
| A. | 充电时碳电极上发生还原反应 | |
| B. | 充电时Ni电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e-=2H+ | |
| D. | 放电时Ni电极反应为Na(OH)+H2O+e-=Ni(OH)2+OH- |
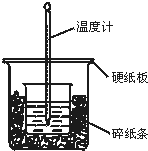 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: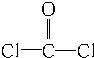 和双酚A:
和双酚A: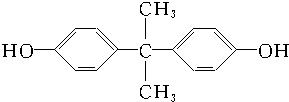 缩聚而成,其反应方程式为
缩聚而成,其反应方程式为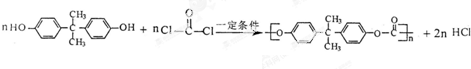 .
.
 $\stackrel{R′OH}{→}$
$\stackrel{R′OH}{→}$ +
+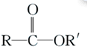
 +RCl→
+RCl→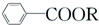 +NaCl
+NaCl .
. +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.