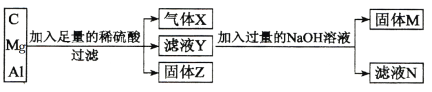
题目内容
【题目】下列比较中,正确的是( )
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B. 0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后:c(![]() )>c(Cl-)>c(Na+)>c(OH-)>c(H+)
)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c(![]() )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
【答案】D
【解析】
A.相同温度相同浓度时HF比HCN易电离,说明HF酸性大于HCN,酸性越强其相应酸根离子水解程度越小,相同浓度的钠盐溶液pH越小;
B.0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后,溶液中的溶质为等物质的量浓度的NH4Cl、NH3.H2O、NaCl,一水合氨电离程度大于铵根离子水解程度导致溶液呈碱性,结合物料守恒判断;
C、任何电解质溶液中都存在电荷守恒;
D、1mol(NH4)2SO4能电离出2mol铵根离子,浓度最大;同浓度时铵根离子水解程度越大,则溶液中铵根离子浓度越小,醋酸根离子促进铵根离子水解;
A.相同温度相同浓度时HF比HCN易电离说明HF酸性大于HCN,酸性越强其相应酸根离子水解程度越小,相同浓度的钠盐溶液pH越小,水解能力CN->F-,所以相同浓度的钠盐溶液pH,NaF<NaCN,故A错误;
B.0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后,溶液中的溶质为等物质的量浓度的NH4Cl、NH3.H2O、NaCl,一水合氨电离程度大于铵根离子水解程度导致溶液呈碱性,则c(OH-)>c(H+),一水合氨电离但程度较小,结合物料守恒得c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故B错误;
C、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故C错误;
D、1mol(NH4)2SO4能电离出2mol铵根离子,浓度最大;相同浓度时铵根离子水解程度越大,则溶液中铵根离子浓度越小,醋酸根离子促进铵根离子水解,一水合氨是弱电解质,电离程度较小,所以c(NH4+)由大到小的顺是:①>②>③>④,故D正确;

【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | Na2O2没有变质 |
B | 取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,最终无淡黄色沉淀 | CH3CH2Br没有水解 |
C | 室温下,用pH试纸测得:0.1 mol·L-1 Na2SO3溶液的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约为5 | HSO |
D | 向少量碘水中加入过量浓FeCl2溶液,分成两等份,向一份中滴加KSCN溶液显红色;向另一份中滴加淀粉溶液显蓝色 | Fe3+与I-的反应为可逆反应 |
A. AB. BC. CD. D
【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D