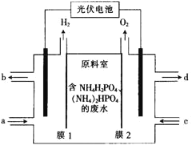
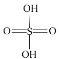
题目内容
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,其元素符号为____。
(2)B元素是前四周期基态原子中的未成对电子数最多的,其基态原子的价电子排布图为_____。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该电子的轨道形状为_____,C的基态原子核外电子占用了_____个原子轨道,被其占用的最外电子层本身有_____个能级。
(4)D元素是自然界中含量居第二位的金属元素,其+3价离子简化的核外电子排布式为______,该离子比同元素的其它离子更稳定的原因是_____。
(5)E元素原子最外层电子数是电子层数的3倍,其核外共有_____种能量不同的电子,写出E的具有18个电子的氢化物的电子式:_____。
【答案】Li、B或F ![]() 球形 15 4 [Ar]3d5 最外层3d能级电子排布半充满,能量更低,更稳定 3
球形 15 4 [Ar]3d5 最外层3d能级电子排布半充满,能量更低,更稳定 3 ![]()
【解析】
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,则A为第二周期元素;
(2)前四周期基态原子中,B元素的未成对电子数最多,则处于第四周期,价电子排布式为3d54s1,故B为Cr;
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,原子核外电子排布为1s22s22p63s23p63d104s1,故C为Cu元素。
(4)自然界中含量前4位元素分别为O、Si、Al、Fe,其中Al、Fe为金属元素;
(5)E元素原子最外层电子数是电子层数的3倍,则基态E原子的电子排布式为1s22s22p4,E为O元素。
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,则A为第二周期元素,满足条件的有Li、B和F三种元素;
(2)B元素是前四周期基态原子中的未成对电子数最多的,价电子排布式为3d54s1,则B为Cr,其基态原子的价电子排布图为![]() ;
;
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,原子核外电子排布为1s22s22p63s23p63d104s1,故C为Cu元素;未成对电子为4s1,该电子的轨道形状为球形;基态Cu原子占用的原子轨道数为1+1+3+1+3+5+1=15;被其占用的最外电子层为第四层,有s、p、d、f共4个能级;
(4)自然界中含量前4位元素分别为O、Si、Al、Fe, D元素是自然界中含量居第二位的金属元素,则D为Fe元素;Fe3+简化的核外电子排布式为[Ar]3d5,该离子比同元素的其它离子更稳定的原因是最外层3d能级电子排布半充满,能量更低,更稳定;
(5)E元素原子最外层电子数是电子层数的3倍,则基态E原子的电子排布式为1s22s22p4,E为O元素,其核外共有3种能量不同的电子;O和H形成的18个电子化合物为H2O2,电子式为![]() 。
。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
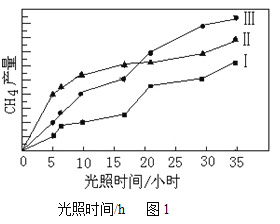
唐印文化课时测评系列答案【题目】CH4和CO2反应可以制造价值更高的化学产品.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
物质 | CH4 | CO2 | CO | H2 |
平衡浓度mol/L | 0.5 | 0.5 | 2.0 | 2.0 |
①此温度下,该反应的平衡常数K=______注明单位.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2kJmol-1
2CO(g)+O2(g)=2CO2(g) ΔH3kJmol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=______ kJmol-1
2CO(g)+2H2(g)的ΔH=______ kJmol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4![]() CH3COOH,请回答:
CH3COOH,请回答:
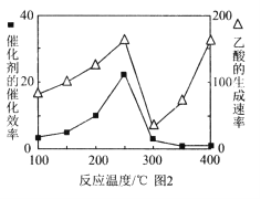
①温度与催化剂的催化效率和乙酸的生成速率如图250~300℃时,温度升高而乙酸的生成速率降低的原因是______
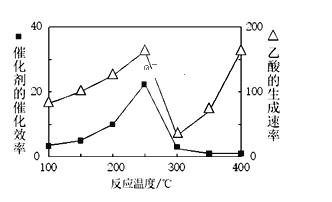
②为提高上述反应CH4的转化率,可采取的措施有______(写2种)
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为______,每消耗3molCu2Al2O4时被还原的HNO3为______mol
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2,原理是:500℃时, CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2, Li4SiO4再生,该原理的化学方程式______.