��Ŀ����
����Ŀ����SO2�ֱ�ͨ������4����Һ�У���ش�����������
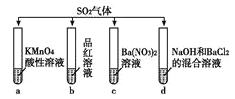
��1���Թ�a������Һ��ɫ������˵��SO2����________�ԣ��Թ�b������Һ��ɫ������˵��SO2����________�ԡ�
��2���Թ�d���ְ�ɫ�������ó����ܹ��ܽ���ϡ�����У�д�����ɸó��������ӷ���ʽ��________________��
��3��������Թ�d�е�NaOH����ΪBr2��BaCl2�Ļ����Һ�����Եõ�һ��������ǿ��İ�ɫ������д���ù����з���������ԭ��Ӧ�����ӷ���ʽ��________��
��4���Թ�c��Ҳ�ɵõ�������ǿ��İ�ɫ��������������ó���������ԭ����________��
���𰸡� ��ԭ Ư�� SO2+2OH-+Ba2+=BaSO3��+H2O ![]()
![]() ����Һ�����ԣ�������������
����Һ�����ԣ�������������![]() ����+4����Ԫ������
����+4����Ԫ������![]() ��
�� ![]() ���Ba2+����BaSO4����
���Ba2+����BaSO4����
����������1���Թ�a������Һ��ɫ����������ر���ԭ��˵��SO2���л�ԭ�ԣ��Թ�b������Һ��ɫ������˵��SO2����Ư���ԡ���2���Թ�d���ְ�ɫ�������ó����ܹ��ܽ���ϡ�����У�˵���������ᱵ��������ɸó��������ӷ���ʽΪSO2+2OH-+Ba2+=BaSO3��+H2O����3��������Թ�d�е�NaOH����ΪBr2��BaCl2�Ļ����Һ�����Եõ�һ��������ǿ��İ�ɫ�������������ڶ�������������Ϊ���ᣬ�����������ᱵ�������ù����з���������ԭ��Ӧ�����ӷ���ʽΪBr2��SO2��2H2O��4H����2Br����SO42������4��������������ˮ��SO2��H2O![]() H2SO3����Һ�����ԣ��������������������+4����Ԫ����������SO42����SO42�����Ba2+����BaSO4������
H2SO3����Һ�����ԣ��������������������+4����Ԫ����������SO42����SO42�����Ba2+����BaSO4������

����Ŀ�����dz��ô�����ѡ��Ӧ���еķ�����ͼ��ʾΪһ��������1mol CH3OH��O2������Ӧʱ������CO��CO2��HCHO�������仯ͼ[��Ӧ��O2��g����������H2O��g����ȥ]��
��1�������д��������£�CH3OH��O2��Ӧ��Ҫ�������CO��CO2����HCHO������2HCHO��g��+O2��g���T2CO��g��+2H2O��g����H= ��
�ڼ״���ȡ��ȩ����Ag������������AgCl��Ӱ��Ag�����Ļ��ԣ��ð�ˮ�����ܽ��ȥ���е�AgCl��д���÷�Ӧ�����ӷ���ʽ�� ��
��2����֪��CO��g��+2H2��g��CH3OH��g����H=��a kJmol��1 ��
�پ��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
�¶ȣ��棩 | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
��ijʱ�̡�250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc��CO��=0.4molL��1��c��H2��=0.4molL��1��c��CH3OH��=0.8molL��1 �� ���ʱv��v�������������������=������
��ij�¶��£�������̶���2L���ܱ������н�1mol CO��2mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ�ȣ�P��/Pǰ�� | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
��0��15min����H2��ʾ��ƽ����Ӧ����Ϊ �� �ﵽƽ��ʱCO��ת����Ϊ ��
��3�������Ƽ�ѭ�����ɳ�ȥSO2 �� ����SO2�Ի�������Ⱦ������Һ����SO2�Ĺ����У�pH��n��SO32������n��HSO3�����仯��ϵ���±���
n��SO32������n��HSO3���� | 91��9 | 1��1 | 1��91 |
pH | 8.2 | 7.2 | 6.2 |
�ٸ����ϱ��ж�NaHSO3��Һ���ԣ�
����NaHSO3��Һ������Ũ�ȹ�ϵ��ȷ���� ������ĸ����
a��c��Na+��=2c��SO32����+c��HSO3����
b��c��Na+����c��HSO3������c��H+����c��SO32������c��OH����
c��c��H2SO3��+c��H+��=c��SO32����+��OH����
d��c��Na+��+c��H+��=c��SO32����+c��HSO3����+c��OH����
