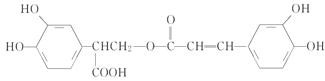
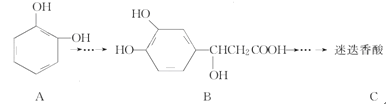
题目内容
【题目】(化学一选修3:物质结构与性质)
氧化亚铜(Cu2O)可用于陶瓷、固体整流器。可用反应制备:2(CuSO4·5H2O) ![]() Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
(1)Cu2O中基态铜的离子的价层电子排布图为_______________。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因__________________。
(2)已知H2SO4的结构式如图所示: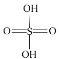 。上述反应中:
。上述反应中:
①在上述产物中,VSEPR模型与硫酸相同的是_________(填化学式,下同),与NO3-互为等电子体的一种分子是________。
②SO32-的杂化类型是________,请比较键角的大小:SO32-_____SO42-(填“>”“<”或“=”)
(3)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)四方晶系CuFeS2晶胞结构如图所示。已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________gcm3(列出计算式)。

【答案】3d10 结构上Cu2+为3d9,而Cu+为3d10全充满更稳定 H2O SO3 sp3 < 16mol,或者16×6.02×1023个 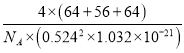
【解析】
(1)Cu原子失去最外层1个电子生成Cu+,根据构造原理书写基态Cu+离子的核外电子排布式;原子轨道处于全空、半满或全满时最稳定,结构上Cu2+为3d9,而Cu+为3d10全充满更稳定,在高温下CuO能分解生成Cu2O;
(2)①H2O中O原子采取sp3杂化,VSEPR模型与硫酸相同的是H2O,与NO3-互为等电子体的一种分子是SO3 ;
②SO32-中心原子的价层电子对数为:3+![]() =4,SO32-的杂化类型是sp3;SO32-有孤电子对,对成键电子对斥力大,键角变小,据此分析SO32-和SO42-键角的大小;
=4,SO32-的杂化类型是sp3;SO32-有孤电子对,对成键电子对斥力大,键角变小,据此分析SO32-和SO42-键角的大小;
(3)1mol配合物[Cu(NH3)4]Cl2中,1mol氨气中含有3molσ键,总共含有σ键的物质的量为:3mol×4=12mol,1mol该配合物中含有4mol配位键,据此进行计算;
(4)根据均摊法进行计算晶胞内共含”CuFeS2“个数;根据m=ρV进行计算。
(1)Cu+离子的价层电子排布式为3d10,由泡利原理、洪特规则,价电子排布图为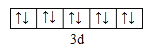 ;Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+的价电子排布式3d10 ,原子轨道处于全空、半满或全满时最稳定,结构上Cu2+为3d9,而Cu+为3d10全充满更稳定,在高温下CuO能分解生成Cu2O。
;Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+的价电子排布式3d10 ,原子轨道处于全空、半满或全满时最稳定,结构上Cu2+为3d9,而Cu+为3d10全充满更稳定,在高温下CuO能分解生成Cu2O。
(2)①H2O,O原子形成2个O-H键,含有2对孤电子对,杂化轨道数目为4,O原子采取sp3杂化,VSEPR模型与硫酸相同的是H2O,与NO3-互为等电子体的一种分子是SO3 。
②SO32-中心原子的价层电子对数为:3+![]() =4,SO32-的杂化类型是sp3;SO32-有孤电子对,对成键电子对斥力大,键角变小,键角的大小:SO32-<SO42-;
=4,SO32-的杂化类型是sp3;SO32-有孤电子对,对成键电子对斥力大,键角变小,键角的大小:SO32-<SO42-;
(3)1mol配合物[Cu(NH3)4]Cl2中,1mol氨气中含有3molσ键,总共含有σ键的物质的量为:3mol×4=12mol,1mol该配合物中含有4mol配位键,所以含有的σ键的物质的量为:12mol+4mol=16mol,或者16×6.02×1023个。
(4)晶胞中Fe原子=8×![]() +4×
+4×![]() +1=4,Cu原子数目=6×
+1=4,Cu原子数目=6×![]() +4×
+4×![]() =4,硫原子数目=8,晶胞内共含4个”CuFeS2“,则晶胞质量=4×
=4,硫原子数目=8,晶胞内共含4个”CuFeS2“,则晶胞质量=4×![]() g,a=b=0.524nm,c=1.032nm,则晶体的密度=4×
g,a=b=0.524nm,c=1.032nm,则晶体的密度=4×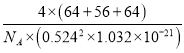 g·cm-3。
g·cm-3。

 阅读快车系列答案
阅读快车系列答案【题目】工业上常采用硝酸工业的含硝尾气制备亚硝酸钠,再利用亚硝酸钠制备亚硝酸钾,相关制备流程如下:
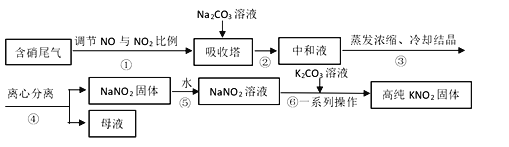
已知:①亚硝酸钠(NaNO2)是一种白色至浅黄色晶体或粉末,受热易分解,露置于空气中缓慢氧化。
②KMnO4在中性或碱性溶液中的还原产物为MnO2,在酸性条件下为Mn2+。
请回答:
(1)下列操作或描述正确的是________。
A. 步骤①调节NO与NO2比例使尾气被碱液充分吸收,且提高NaNO2产率
B. 在吸收塔中含硝尾气从底部通入,Na2CO3溶液从塔顶喷淋
C. 母液中溶质只有Na2CO3和NaNO3
D. 所得NaNO2固体产品中含有杂质NaNO3
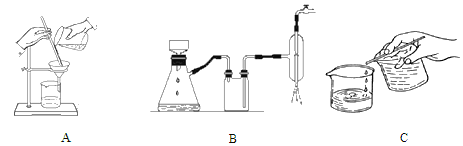
(2)离心分离是一种固液分离操作,步骤④可用以下三个操作中的________(选最佳)代替。
(3)NaNO2产品纯度分析。若用NaNO2待测液滴定酸性KMnO4标准溶液,终点现象是___,测定结果与真实值非常接近;而采用酸性KMnO4标准液滴定NaNO2待测液的方法进行测定,根据滴定结果计算NaNO2产品纯度总是大于100%,可能的原因是________。
(4)已知相关物质的溶解表如下:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
Na2CO3 | 7 | 21.5 | 49 | 46 | 43.9 |
K2CO3 | 105 | 111 | 117 | 127 | 140 |
NaNO2 | 71.2 | 80.8 | 94.9 | 111 | 113 |
KNO2 | 279 | 306 | 329 | 348 | 376 |
(i)根据相关物质溶解性信息,写出步骤⑥的化学方程式________。
(ii)步骤⑥正确的操作顺序为:b→_____→_____→c。
a 在85℃下蒸发浓缩,并不断将析出的Na2CO3晶体捞出
b 将NaNO2溶液与K2CO3溶液充分混合
c 离心分离,在60~70℃下干燥,迅速冷却,密封储存
d 热溶液冷却结晶获得高纯KNO2
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据如下:
3![]() +8HNO3→3
+8HNO3→3![]() +8NO↑+7H2O
+8NO↑+7H2O
物质 | 相对分子质量 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 100 | 0.962 g/cm3 | 25.9℃ | 160.8℃ | 20℃时,在水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 146 | 1.360 g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g。易溶于乙醇,不溶于苯 |
步骤Ⅰ:在如图装置的三颈烧瓶中加入16 mL 50%的硝酸(过量,密度为1.310 g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。

步骤Ⅱ:水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
步骤Ⅲ:当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
步骤Ⅳ:趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后抽滤、洗涤、干燥、称重。请回答下列问题:
(1)装置b的名称为__________,使用时要从_________(填“上口”或“下口”)通入冷水;滴液漏斗的细支管a的作用是________________。
(2)实验中,先将温度由室温升至50℃左右,再慢慢控制在60℃~65℃之间,最后控制在80℃~90℃,目的是____________________。
(3)本实验所用的50%的硝酸物质的量浓度为____________;实验中,氮氧化物废气(主要成分为NO和NO2)可以用NaOH溶液来吸收,其主要反应为NO+NO2+2NaOH == 2NaNO2+H2O。其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的方程式:______________________________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水或______洗涤晶体。
(5)通过称量得到产物7.00 g,则本实验产率为__________(精确到0.1%)。