题目内容
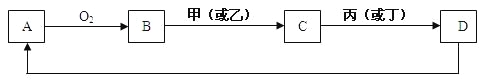
【题目】已知甲、乙、丙、丁是中学化学中四种常见的物质,其转化关系如图所示。则甲和丁可能是
![]()
①N2和O2 ②C12和Fe ③C和O2 ④SO2和NaOH溶液
A.①②B.①②③C.②③④D.①②③④
【答案】C
【解析】
从图可知,甲与丁反应生成乙,乙进一步与丁反应生成丙,丙又能与甲生成乙,此为与量或反应条件等有关的物质转化关系,可结合每组物质的性质进行逐个分析。
①若甲和丁为N2和O2,N2和O2在放电条件下反应生成NO,NO与O2反应生成NO2,但NO2无法与N2反应生成NO,转化关系错误;
②若甲和丁为Cl2和Fe,氯气和铁点燃反应生成氯化铁,氯化铁溶液与铁反应生成氯化亚铁,氯化亚铁溶液与氯气反应生成氯化铁,转化关系正确;
③若甲和丁为C和O2,氧气与碳反应生成二氧化碳,二氧化碳与碳在高温条件下反应生成一氧化碳,一氧化碳与氧气反应生成二氧化碳,转化关系正确;
④若甲和丁为SO2和NaOH溶液,二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠溶液与二氧化硫反应生成亚硫酸氢钠,亚硫酸氢钠与氢氧化钠反应生成亚硫酸钠和水,转化关系正确;
所以符合题意的是②③④;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在l0℃时,10 mL 0.4 mol L-1H2O2溶液发生催化分解:2H2O2![]() 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~2 min的平均反应速率比4~6 min快
B. 0~6 min 的平均反应速率v(H2O2)=3.3×10-2 moL-1 L-1 min-1
C. 反应至 6 min 时,c(H2O2)=0.3 mol·L-1
D. 反应至6 min时,H2O2分解了50%
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
(2)从下表中选择,称量NaOH固体所需要的仪器是(填字母)________。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
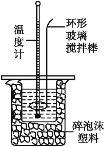
(1)若生成1 mol H2O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式:__________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②用上述实验数值计算结果为____kJmol-1,与57.3 kJmol-1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO![]() +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO![]() =SO
=SO![]() +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O