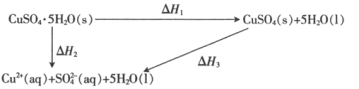
题目内容
【题目】表示下列反应的离子方程式正确的是
A.金属钠加入CuSO4溶液中:![]()
B.金属铝加入NaOH溶液中:![]()
C.铁粉加入FeC13溶液中:![]()
D.铜片插入浓HNO3溶液中:![]()
【答案】C
【解析】
A. 由于钠很活泼,能和水发生剧烈反应,所以,在CuSO4溶液中投入钠,钠不会置换出Cu,而是与水反应,A选项错误;
B. 反应方程式没有配平,正确写法为:2Al+2OH-+2H2O=2AlO2-+3H2↑,B选项错误;
C. 铁粉加入FeC13溶液中:Fe+ 2Fe3+=3Fe2+,方程式遵守电子得失守恒、电荷守恒、质量守恒,书写正确,C选项正确;
D. 铜片插入浓HNO3溶液中生成的是NO2:Cu+4HNO3(浓)= Cu(NO3)2 +2NO2↑+2H2O,D选项错误;
答案选C。

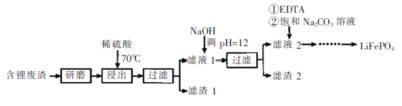
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下:
资料:i滤液1、滤液2中部分例子浓度(g·L-1)
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物
iii.某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 32.7 | 31.7 | 30.9 |
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是____。
(2)滤渣2的主要成分有____。
(3)向滤液2中先加入EDTA,再加入饱和Na2C03溶液,90℃充分反应后,分离出固体 Li2CO3粗品的操作是_______。
(4)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(摩尔质量:Li2CO3 74 g.mol4)
II.纯化Li2CO3粗品
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO31溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是____,该池使用了_________(填“阳”或“阴”)离子交换膜。

Ⅲ.制备 LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________。
【题目】某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制 0.5 mol·L-1 FeSO4 溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用____。该实验小组做如下实验。
实验序号 | 操作及现象 |
ⅰ | 取 2 mL 上述 FeSO4 溶液于试管中,逐滴加入少量 0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
ⅱ | 取 2 mL 上述 FeSO4 溶液于试管中,加入 2 滴 1 mol·L-1 KSCN 溶液无现象,通入一段时间 O2,溶液变为浅红色 |
ⅲ | 重复实验ⅱ,向浅红色溶液中加入 5% H2O2 溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是 FeS。Na2S 溶液呈碱性,FeSO4 溶液与其反应不生成 Fe(OH)2而生成 FeS 的可能原因是_____。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:______、_____。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a.Fe3+ 被H2O2 还原 b.SCN- 被O2 氧化 c.SCN- 被H2O2 氧化
乙同学根据上述实验现象认为假设 b 不成立,他依据的现象是_____,甲同学利用上述部分试剂,通过以下实验验证了假设 c 成立。请将以下实验操作及现象补充完整。
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加 FeCl3 溶液 | ① ___ |
ii | ② ___ | ③ ___ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置 A 接入下图所示的装置中,打开 K1 和 K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。C、D 中的溶液依次是 BaCl2 溶液和品红溶液,现象依次出现白色沉淀和品红褪色,写出硫酸亚铁高温分解反应的化学方程式________。