题目内容
【题目】A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
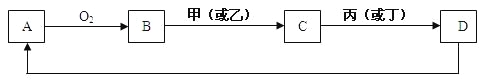
试回答:
(1) 写出B在工业生产中的一种用途___________________。
(2)写出B转化为C的可能的离子方程式____________________________。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理_______________。
(4)若C为钠盐,用含m mol C的溶液与1L n mol·L-1的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为________mol。
(5)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式_______________________;若负极材料消耗18g,则电池转移的电子总数为_________。 (阿伏加德罗常数用NA表示)
【答案】工业上制备Al(或作耐火材料) Al2O3+6H+=2Al3++3H2O Al2O3+2OH—+3H2O = 2[Al(OH)4]— 或
Al2O3+2OH—=AlO2–+H2O Al3++3H2O![]() Al(OH)3(胶体)+3H+ (4m-n)/3mol O2+2H2O+4e—=4OH— 2NA
Al(OH)3(胶体)+3H+ (4m-n)/3mol O2+2H2O+4e—=4OH— 2NA
【解析】
由题意:A是单质,与氧气反应生成B为氧化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应,为酸与碱的反应,甲与丁为同类物质,丙与乙为同类物质,氧化物B能与酸或碱反应生成C,D是A单质所含元素的最高价氧化物的水化物,结合转化关系,可知B为Al2O3,则A为Al、C为Al(OH)3,
(1)氧化铝可以制备Al(或作耐火材料)等;
(2)B转化生成C为氧化铝与强碱或强酸的反应;
(3)若C的溶液显酸性,则C为铝盐,溶液中铝离子水解生成氢氧化铝胶体,可以净水;
(4)若C为钠盐,甲为NaOH,C为NaAlO2,根据 AlO2-+H2O+H+=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O计算剩余的氢氧化铝的物质的量;
(5)Al为负极、铂电极为正极,氧气在正极获得电子生成氢氧根离子;根据Al元素化合价变化计算转移电子数目.
由题意:A是单质,与氧气反应生成B为氧化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应,为酸与碱的反应,甲与丁为同类物质,丙与乙为同类物质,氧化物B能与酸或碱反应生成C,D是A单质所含元素的最高价氧化物的水化物,结合转化关系,可推知B为Al2O3,则A为Al、C为Al(OH)3,,则:
(1)Al2O3在工业上制备Al(或作耐火材料);
(2)B转化生成C为氧化铝与强碱或强酸的反应,反应离子方程式为:Al2O3+6H+=2Al3++3H2O 或Al2O3+2OH-=2AlO2-+H2O,Al2O3+2OH—+3H2O = 2[Al(OH)4]—;
(3)若C的溶液显酸性,C为铝盐,溶液中铝离子水解Al3++3H2O![]() Al(OH)3(胶体)+3H+,生成氢氧化铝胶体,可以净水;
Al(OH)3(胶体)+3H+,生成氢氧化铝胶体,可以净水;
(4)若C为钠盐,甲为NaOH,C为NaAlO2,1L n mol·L-1的盐酸中n(HCl)=n mol,由于n(NaAlO2):n(HCl)=1:2,故按AlO2-+H2O+H+=Al(OH)3↓反应,盐酸有剩余,能部分溶解氢氧化铝,则:
AlO2-+H2O+H+=Al(OH)3↓
m mol m mol m mol
剩余n(H+)=n mol-m mol=(n-m)mol
Al(OH)3+3H+=Al3++3H2O
(n-m)/3mol (n-m)mol
得到氢氧化铝沉淀为:m mol-(n-m)/3mol=(4m-n)/3mol;
(5)Al为负极、铂电极为正极,氧气在正极得电子生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,18gAl的物质的量,n(Al)=18g/27g·mol-1=2/3mol,故转移电子数目=2/3mol×3×NAmol-1=2NA.

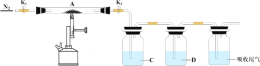
【题目】某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制 0.5 mol·L-1 FeSO4 溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用____。该实验小组做如下实验。
实验序号 | 操作及现象 |
ⅰ | 取 2 mL 上述 FeSO4 溶液于试管中,逐滴加入少量 0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
ⅱ | 取 2 mL 上述 FeSO4 溶液于试管中,加入 2 滴 1 mol·L-1 KSCN 溶液无现象,通入一段时间 O2,溶液变为浅红色 |
ⅲ | 重复实验ⅱ,向浅红色溶液中加入 5% H2O2 溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是 FeS。Na2S 溶液呈碱性,FeSO4 溶液与其反应不生成 Fe(OH)2而生成 FeS 的可能原因是_____。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:______、_____。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a.Fe3+ 被H2O2 还原 b.SCN- 被O2 氧化 c.SCN- 被H2O2 氧化
乙同学根据上述实验现象认为假设 b 不成立,他依据的现象是_____,甲同学利用上述部分试剂,通过以下实验验证了假设 c 成立。请将以下实验操作及现象补充完整。
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加 FeCl3 溶液 | ① ___ |
ii | ② ___ | ③ ___ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置 A 接入下图所示的装置中,打开 K1 和 K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。C、D 中的溶液依次是 BaCl2 溶液和品红溶液,现象依次出现白色沉淀和品红褪色,写出硫酸亚铁高温分解反应的化学方程式________。