题目内容
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol-1
②2CO(g)+ O2(g)= 2CO2(g) △H= _556.0 kJ·mol-1
③H2O(l) = H2O(g) △H="+" 44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
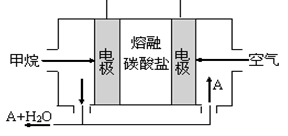
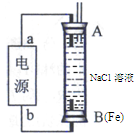
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。则电源中a极为 极(填“正”或“负”),其电极反应式为 。装置上端A极电极材料是 (填化学式),B电极上的电极反应式为 。
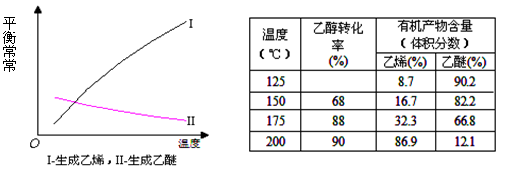
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g) +H2O(g) CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
①该反应的正反应为 (填“吸”或“放”)热反应。
②实验1中,以v(H2)表示的平均反应速率为 。
③900℃时,按CO(g)、H2O(g)、CO2(g) 和H2(g)的物质的量分别是0.8mol、1.0mol、0.6 mol和0.8 mol分别加入该容器,则此时反应的v(正) v(逆)(填“>”“<”或“=”中之一)。
④实验3跟实验2相比,改变的条件可能是 。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol-1
②2CO(g)+ O2(g)= 2CO2(g) △H= _556.0 kJ·mol-1
③H2O(l) = H2O(g) △H="+" 44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。则电源中a极为 极(填“正”或“负”),其电极反应式为 。装置上端A极电极材料是 (填化学式),B电极上的电极反应式为 。

(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g) +H2O(g)
 CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为 (填“吸”或“放”)热反应。
②实验1中,以v(H2)表示的平均反应速率为 。
③900℃时,按CO(g)、H2O(g)、CO2(g) 和H2(g)的物质的量分别是0.8mol、1.0mol、0.6 mol和0.8 mol分别加入该容器,则此时反应的v(正) v(逆)(填“>”“<”或“=”中之一)。
④实验3跟实验2相比,改变的条件可能是 。
(1)CH3OH(l)+ O2(g)=" CO" (g)+2H2O(l) △H= _447.8 kJ·mol-1(2分);
(2)正(1分),O2+4e-+2H2O=4OH-(2分),Fe(1分),2H++2 e-=H2(或2H2O+2e-=H2+2OH-)(2分);
(3)① 放(2分)②0.16mol/(L·min) (2分)③<(2分)④使用了催化剂;加大了压强 (任答一种,2分)。
试题分析:
(1)根据题给的热化学方程式,可将(①-②)/2+③可得出:CH3OH(l)+ O2(g)=" CO" (g)+2H2O(l) △H= _447.8 kJ·mol-1;
(2)根据装置图和生成的氢氧化亚铁较长时间不变色可知,AB两端中一端生成的亚铁离子而不能生成氯气(氯气具有强氧化性),另一端生成氢气,故A端为阳极,电极材料为铁,放电生成亚铁离子;B端为阴极,电极材料为铁,电极反应式为:2H++2 e-=H2(或2H2O+2e-=H2+2OH-);甲醇燃料电池中,a端为正极,发生的电极反应为:O2+4e-+2H2O=4OH-;
(3)分析1、2两组实验数据,1组中k=2.67,2组中k=0.17,故此随温度的升高k值减小,说明反应正向放热;1组中达到平衡时,c(H2)=0.8mol/L,反应时间为5min,故反应速率为:v(H2)=0.16mol/(L·min);若在900℃时,按CO(g)、H2O(g)、CO2(g) 和H2(g)的物质的量分别是0.8mol、1.0mol、0.6 mol和0.8 mol分别加入该容器,则Qc=0.6,大于此温度下的k值,此时反应向逆向移动,故v(正)<v(逆) ;再对比2、3组实验数据,可知反应没有发生移动,只是反应速率加快,故此可能是使用了催化剂或加大了压强。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

 2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。
2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。 N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。

 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 CH3OH(g) ΔH
CH3OH(g) ΔH