题目内容
下列四个图像的有关说法正确的是
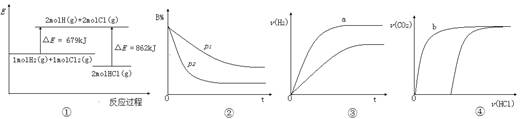

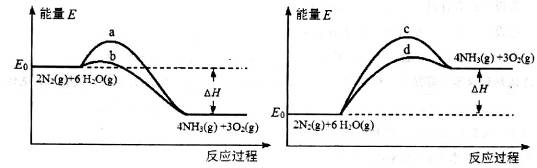
| A.①表示反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的△H="183" kJ·mol-1 |
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 |
| C.③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液 |
| D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3两种溶液中,分别滴加0.l mol/L HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液 |
D
试题分析:A、由图像可知反应物总能量比生成物总能量高,反应是放热反应,△H<0,错误; B、由图像可知,压强越大,B的体积分数越小,说明增大压强,平衡向右移动,所以D一定不是气体,错误;C、体积和pH均相同的HCl、CH3COOH两种溶液中醋酸物质的量大,因锌足量,所以氢气的体积与酸的物质的量成正比,a表示醋酸,错误;D、向碳酸钠溶液中滴加盐酸,先无气体后产生气体。向碳酸氢钠溶液中滴加盐酸,立即产生气体,正确。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 CH3OH(g) ΔH
CH3OH(g) ΔH

 HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol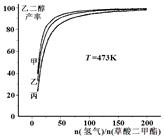
 H++OH-、HC2O4-
H++OH-、HC2O4- 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。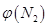 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。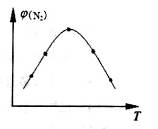
 CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据: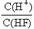 的值始终保持增大
的值始终保持增大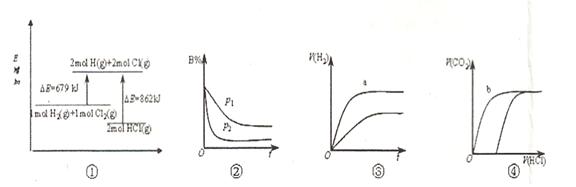
 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体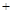 CO(g)
CO(g) CH3OH(g)
CH3OH(g)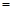 kJ;
kJ; )
)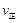 (甲醇)
(甲醇) 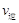 (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。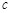 (CH3OH)
(CH3OH)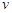 (CH3OH)
(CH3OH)