题目内容
【题目】I.(1)下列右侧对左侧物质的描述与左侧任何物质都不对应的是_________(填右侧小写的编号);
物质 描述
A.四氧化三铁 a.自来水消毒剂
B.过氧化钠 b.工业制玻璃
C.碳酸氢钠 c.红色油漆和涂料
D.硅酸钠 d.木材防火剂
E.明矾 e.呼吸面具中氧气的来源
F.青铜 f.制光纤的材料
G.硅 g.用量最大的金属材料
H.氯气 h.焰色反应为绿色
II.(2)明矾溶液中加少量Ba(OH)2溶液的离子方程式 ______________;
(3)漂白粉溶液中通过量CO2的离子方程式________________;
(4)将KFe2Si3O8(OH)2改写为氧化物的形式________________,1mol KFe2Si3O8(OH)2和足量稀盐酸反应,消耗HCl的物质的量为________mol;
(5)配平下面的离子方程式,并用双线桥表示反应的电子转移:______
SO32- + MnO4- + — SO42-+ Mn2+ +______
III.(6)若要除去下列物质中的杂质(括号内为杂质),请将选用的试剂填入表格。
物质(杂质) | 试剂 |
NaHCO3溶液(Na2CO3) | ①______ |
FeCl3溶液(FeCl2) | ②______ |
SiO2(CaCO3) | ③______ |
Fe2O3(SiO2) | ④______ |
【答案】b c f g 2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 2Al(OH)3↓+ 3BaSO4↓ ClO- + CO2 + H2O = HCO3- + HClO K2O·2FeO·Fe2O3·6SiO2·2H2O, 6 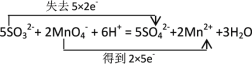 过量CO2 Cl2 盐酸 NaOH溶液
过量CO2 Cl2 盐酸 NaOH溶液
【解析】
I.⑴过氧化钠是呼吸面具中氧气的来源;碳酸氢钠的焰色反应为绿色;硅酸钠主要作木材防火剂;氯气常作自来水消毒剂。
II.⑵明矾溶液中加少量Ba(OH)2溶液,按照少定多变的思想书写。
⑶漂白粉溶液中通过量CO2生成碳酸氢钙和次氯酸。
⑷将KFe2Si3O8(OH)2同时扩大2倍改写为氧化物的形式,主要是K2O·2FeO·Fe2O3在消耗盐酸,根据量的关系计算消耗盐酸的物质的量。
⑸配平下面的离子方程式,亚硫酸根升高2个价态,高锰酸根降低5个价态,根据得失电子守恒进行配平,再用双线桥表示反应的电子转移。
III.⑹ NaHCO3溶液(Na2CO3)用足量二氧化碳与碳酸钠反应生成碳酸氢钠;FeCl3溶液(FeCl2),用足量氯水或通氯气与氯化亚铁反应生成氯化铁;SiO2(CaCO3),加盐酸,碳酸钙与盐酸反应后再过滤得到二氧化硅,Fe2O3(SiO2),加氢氧化钠等强碱溶液反应生成易溶于水的硅酸盐,再过滤得到氧化铁。
I.⑴过氧化钠是呼吸面具中氧气的来源;碳酸氢钠的焰色反应为绿色;硅酸钠主要作木材防火剂;氯气常作自来水消毒剂,因此b、c、f、g没有对应关系,故答案为:b、c、f、g。
II.⑵明矾溶液中加少量Ba(OH)2溶液,按照少定多变的思想,写出的离子方程式 2Al3+ + 3SO42- + 3Ba2+ + 6OH-= 2Al(OH)3↓+ 3BaSO4↓;故答案为:2Al3+ + 3SO42- + 3Ba2+ + 6OH-= 2Al(OH)3↓+ 3BaSO4↓。
⑶漂白粉溶液中通过量CO2生成碳酸氢钙和次氯酸,其离子方程式ClO- + CO2 + H2O = HCO3- + HClO;故答案为:ClO- + CO2 + H2O = HCO3- + HClO。
⑷将KFe2Si3O8(OH)2改写为氧化物的形式,同时扩大2倍得到K2O·2FeO·Fe2O3·6SiO2·2H2O,1mol KFe2Si3O8(OH)2和足量稀盐酸反应,主要是K2O·2FeO·Fe2O3·在消耗盐酸,因此消耗HCl的物质的量为6mol;故答案为:K2O·2FeO·Fe2O3·6SiO2·2H2O;6。
⑸配平下面的离子方程式,亚硫酸根升高2个价态,高锰酸根降低5个价态,根据得失电子守恒进行配平,得到离子方程式,并用双线桥表示反应的电子转移:
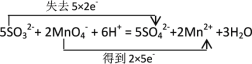 ,故答案为:
,故答案为: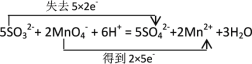 。
。
III.⑹ NaHCO3溶液(Na2CO3)用足量二氧化碳与碳酸钠反应生成碳酸氢钠;FeCl3溶液(FeCl2),用足量氯水或通氯气与氯化亚铁反应生成氯化铁;SiO2(CaCO3),加盐酸,碳酸钙与盐酸反应后再过滤得到二氧化硅,Fe2O3(SiO2),加氢氧化钠等强碱溶液反应生成易溶于水的硅酸盐,再过滤得到氧化铁;故答案为:过量CO2;Cl2;盐酸;NaOH溶液。

 新思维寒假作业系列答案
新思维寒假作业系列答案