题目内容
【题目】硝酸铵简称硝铵,可用作化肥,含氮量高。它在发生某些反应时既放出大量热又生成大量气体而爆炸,也可作炸药使用。
(1)硝铵受热:NH4NO3→N2O↑+2H2O,该反应中因为有____而属于氧化还原反应,其中发生还原过程元素的变化为___。
(2)硝铵受撞击:2NH4NO3→O2+2N2+4H2O,请在该反应方程式上补齐电子转移的方向和数目___。若反应中转移电子数为3.01×1024,则反应产生的气体在标准状况下的体积为____。
(3)一定温度下,硝铵分解:___NH4NO3→___HNO3+___N2↑+___H2O,配平该反应方程式,把系数填入对应的位置上。反应中被氧化与被还原的原子的物质的量之差为5mol时,参加反应的硝铵的质量为___。
(4)硝铵易溶于水,溶解时溶液的温度降低。硝铵溶于水时,温度降低的原因是_____,该水溶液呈(填“酸”“碱”或“中”)____性,用离子方程式表示原因为_____。
(5)为使该水溶液在常温下的pH为7,并不引入杂质,可以_____,试证明所得的溶液中c(NH4+)=c(NO3-):_______。
【答案】电子的转移 NO3-→N2O 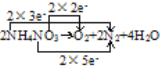 33.6 L 5 2 4 9 1000g 硝酸铵溶于水时扩散过程的吸热量大于水合过程的放热量 酸 NH4++H2O
33.6 L 5 2 4 9 1000g 硝酸铵溶于水时扩散过程的吸热量大于水合过程的放热量 酸 NH4++H2O![]() NH3H2O+H+ 加入适量氨水 溶液中存在NH4+、NO3-、H+、OH-,溶液呈电中性:c(NH4+)+c(H+)=c(NO3-)+c(OH-),因为c(H+)=c(OH-),所以c(NH4+)=c(NO3-)(其他证明方法,合理即得分)
NH3H2O+H+ 加入适量氨水 溶液中存在NH4+、NO3-、H+、OH-,溶液呈电中性:c(NH4+)+c(H+)=c(NO3-)+c(OH-),因为c(H+)=c(OH-),所以c(NH4+)=c(NO3-)(其他证明方法,合理即得分)
【解析】
(1)有电子转移的反应为氧化还原反应,元素化合价降低的过程为还原过程;
(2)根据化合价变化,用双线桥标出电子转移情况;根据电子转移关系计算生成气体的体积;
(3)根据得失电子守恒,配平方程式;由配平的方程式找出被氧化与被还原的原子的物质的量之差与反应物的关系,以此计算;
(4)硝酸铵溶于水吸热;硝酸铵是强酸弱碱盐,水解显酸性;
(5)由水解的离子方程式NH4++H2O![]() NH3H2O+H+,根据平衡移动来解答;根据在硝酸铵和氨水的混合溶液中存在电荷守恒关系证明。
NH3H2O+H+,根据平衡移动来解答;根据在硝酸铵和氨水的混合溶液中存在电荷守恒关系证明。
(1)在NH4NO3→N2O↑+2H2O中,NH4+中氮元素化合价从-3价升高到+1价,NO3-中氮元素化合价从+5价降低到+1价,发生电子转移,属于氧化还原反应,其中发生还原过程元素的变化为NO3-→N2O,
因此,本题正确答案是:电子的转移;NO3-→N2O;
(2)根据化合价变化,用双线桥标出电子转移为: 。由此可知,每生成2molN2转移10mol电子,则若反应中转移电子数为3.01×1024,即转移5mol电子时,则反应产生的气体为1molN2和0.5molO2,在标准状况下的体积为1.5mol×22.4L/mol=33.6L,
。由此可知,每生成2molN2转移10mol电子,则若反应中转移电子数为3.01×1024,即转移5mol电子时,则反应产生的气体为1molN2和0.5molO2,在标准状况下的体积为1.5mol×22.4L/mol=33.6L,
因此,本题正确答案是: ;33.6 L;
;33.6 L;
(3)在反应NH4NO3→HNO3+N2↑+H2O中,NH4NO3中的NH4+被氧化,NO3-部分被还原,根据得失电子守恒,配平方程式为:5NH4NO3→2HNO3+4N2↑+9H2O;
由配平方程式可知,若有5mol NH4NO3分解,被氧化与被还原的原子的物质的量之差为5mol-3mol=2mol,所以当反应中被氧化与被还原的原子的物质的量之差为5mol时,参加反应的硝铵的质量为![]() ×5mol×80g/mol=1000g,
×5mol×80g/mol=1000g,
因此,本题正确答案是:5 ;2 ;4 ;9 ;1000g;
(4)硝酸铵溶于水时扩散过程的吸热量大于水合过程的放热量,使溶液的温度降低;
硝酸铵是强酸弱碱盐,水解显酸性,离子方程式为NH4++H2O![]() NH3H2O+H+,
NH3H2O+H+,
因此,本题正确答案是:酸;NH4++H2O![]() NH3H2O+H+;
NH3H2O+H+;
(5)由NH4++H2O![]() NH3H2O+H+可知,向硝酸铵溶液中加入适量氨水,可以使平衡逆向移动,溶液pH可以为7,且不引入杂质;
NH3H2O+H+可知,向硝酸铵溶液中加入适量氨水,可以使平衡逆向移动,溶液pH可以为7,且不引入杂质;
在硝酸铵和氨水的混合溶液中存在NH4+、NO3-、H+、OH-,溶液呈电中性:c(NH4+)+c(H+)=c(NO3-)+c(OH
因此,本题正确答案是:加入适量氨水;溶液中存在NH4+、NO3-、H+、OH-,溶液呈电中性:c(NH4+)+c(H+)=c(NO3-)+c(OH-),因为c(H+)=cc(OH-),所以c(NH4+)=c(NO3-)。

 名校课堂系列答案
名校课堂系列答案