题目内容
【题目】下列物质的溶液因发生水解而呈碱性的是
A. Na2CO3 B. Na2SO4 C. CuSO4 D. SO2
【答案】A
【解析】
物质的水溶液因发生水解而显碱性的是强碱弱酸盐,弱酸根离子结合水电离出的氢离子生成弱电解质,促进水的电离,溶液氢氧根离子浓度大于氢离子浓度,溶液呈碱性。
A. Na2CO3 溶液显碱性是因为:CO32-+H2O![]() HCO3-+OH-, A正确;
HCO3-+OH-, A正确;
B. Na2SO4属于强酸强碱盐,不水解,溶液显中性,B错误;
C. CuSO4溶液显酸性是因为:Cu2++2H2O![]() Cu(OH)2+2H+, C错误;
Cu(OH)2+2H+, C错误;
D. SO2和水反应生成亚硫酸,亚硫酸电离出氢离子,溶液显酸性,不是水解的原因,D错误;
综上所述,本题选A。

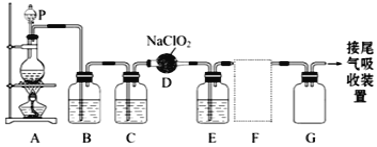
【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______400℃(填“”、“<”或“=”),理由是_______。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) = _______。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______,理由是_______。
③下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡