题目内容
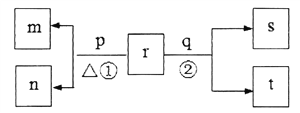
【题目】同一短周期元素甲、乙、丙、丁原子序数依次增大。常温下,含甲的化合物r浓度为0.1mol·L-1时溶液pH=13。同周期元素简单离子中,乙离子的半径最小。p和q分别是元素丙和丁的单质,其中p为浅黄色固体。上述物质的转化关系如图所示(产物水已略去)。下列说法不正确的是
A. 原子半径的大小关系:甲>乙>丙>丁
B. 反应②的离子方程式为:C12+H2O![]() H++C1-+HC1O
H++C1-+HC1O
C. m、n的阴离子在酸性条件下不能大量共存
D. 甲、乙、丁的最高价氧化物对应水化物两两之间均可以发生反应
【答案】B
【解析】p是元素丙的单质,p为浅黄色固体,丙为S元素,p为单质硫;甲、乙、丙、丁是同一短周期元素且原子序数依次增大,丁为Cl元素,q为Cl2,甲、乙都是第三周期元素;含甲的化合物r浓度为0.1mol/L时溶液pH=13,r为一元强碱,甲为Na元素,r为NaOH;同周期元素简单离子中,乙离子半径最小,乙为Al元素。A项,同周期从左到右原子半径逐渐减小,原子半径:甲![]() 乙
乙![]() 丙
丙![]() 丁,A项正确;B项,反应②为Cl2与NaOH的反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,B项错误;C项,反应①为S与NaOH的反应,反应的离子方程式为3S+6OH-
丁,A项正确;B项,反应②为Cl2与NaOH的反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,B项错误;C项,反应①为S与NaOH的反应,反应的离子方程式为3S+6OH-![]() 2S2-+SO32-+3H2O,S2-、SO32-酸性条件下发生归中反应不能大量共存,反应的离子方程式为2S2-+SO32-+6H+=3S↓+3H2O,C项正确;D项,甲、乙、丁的最高价氧化物对应水化物依次为NaOH、Al(OH)3、HClO4,相互间发生的反应有:NaOH+Al(OH)3=NaAlO2+2H2O、NaOH+HClO4=NaClO4+H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O,D项正确;答案选B。
2S2-+SO32-+3H2O,S2-、SO32-酸性条件下发生归中反应不能大量共存,反应的离子方程式为2S2-+SO32-+6H+=3S↓+3H2O,C项正确;D项,甲、乙、丁的最高价氧化物对应水化物依次为NaOH、Al(OH)3、HClO4,相互间发生的反应有:NaOH+Al(OH)3=NaAlO2+2H2O、NaOH+HClO4=NaClO4+H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O,D项正确;答案选B。

【题目】下列各组物质,不能按 ![]() (“―→”表示反应一步完成)关系转化的是( )
(“―→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-==HCO3-+HCN
B. HCOOH的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)]
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. 酸性强弱顺序是HCOOH>HCN>H2CO3